FKM多光谱荧光动态显微成像系统


FKM(Fluorescence Kinetic Microscope)多光谱荧光动态显微成像系统是目前功能为强大全面的植物显微荧光研究仪器,是基于FluorCam叶绿素荧光成像技术的显微成像定制系统。它由包含可扩展部件的增强显微镜、高分辨率CCD相机、激发光源组、光谱仪、控温模块以及相应的控制单元和专用的工作站与分析软件组成。它不仅可以进行微藻、单个细胞、单个叶绿体乃至基粒-基质类囊体片段进行Fv/Fm、Kautsky诱导效应、荧光淬灭、OJIP快速荧光响应曲线、QA再氧化等各种叶绿素荧光及MCF多光谱荧光(multicolor fluorescence)成像分析;还能通过激发光源组进行进行任意荧光激发和荧光释放波段的测量,从而进行GFP、DAPI、DiBAC4、SYTOX、CTC等荧光蛋白、荧光染料以及藻青蛋白、藻红蛋白、藻胆素等藻类特有荧光色素的成像分析;更可以利用光谱仪对各种荧光进行光谱分析,区分各发色团(例如PSI和PSII及各种捕光色素复合体等)并进行深入分析。
FKM多光谱荧光动态显微成像系统使荧光成像技术真正成为光合作用机理研究的探针,使科研工作者在藻类和高等植物细胞与亚细胞层次深入理解光合作用过程及该过程中发生的各种变化,为直接研究叶绿体中光合系统的工作机理提供了为有力的工具。FKM作为藻类/植物表型和基因型显微研究的双重利器,得到了学界的广泛认可并取得了大量的科研成果。
功能特点
· 内置现今叶绿素荧光研究的全部程序,如Fv/Fm、Kautsky诱导效应、荧光淬灭、OJIP快速荧光响应曲线、QA再氧化等,可获得70余项参数。
· 配备10倍、20倍、40倍、63倍和100倍专用生物荧光物镜,可以清晰观测到叶绿体及其发出的荧光。
· 激发光源组中包括红外光、红光、蓝光、绿光、白光、紫外光和远红光等,通过红蓝绿三色光还可以调出可见光谱中的任何一种色光,能够研究植物/藻类中任何一种色素分子或发色团。
· 可进行GFP、DAPI、DiBAC4、SYTOX、CTC等荧光蛋白、荧光染料的成像分析
· 高分辨率光谱仪能够深入解析各种荧光的光谱图。
· 控温系统可以保证实验样品在同等温度条件下进行测量,提高实验精度,也可以进行高温/低温胁迫研究。


应用领域
· 
 微藻、大型藻类/高等植物的单个细胞、单个叶绿体、基粒-基质类囊体片段等的显微结构植物光合生理研究
微藻、大型藻类/高等植物的单个细胞、单个叶绿体、基粒-基质类囊体片段等的显微结构植物光合生理研究
· 藻类/植物逆境研究
· 生物和非生物胁迫的研究
· 藻类/植物抗胁迫能力及易感性研究
· 突变体筛选及光合机理研究
· 藻类长势与产量评估
· 藻类特有色素与光合作用关系
· 藻类/植物——微生物交互作用研究
· 藻类/植物——原生动物交互作用研究
· 基因工程与分子生物学研究
测量样品
· 植物活体切片
· 植物表皮
· 植物细胞
· 绿藻、蓝藻等各种单细胞和多细胞微藻
· 叶绿体提取液
· 类囊体提取液
· 含有叶绿体的原生动物
工作原理
FKM分析过程中,通过连接在显微镜上的激发光源组和内置在6位滤波轮中的一系列滤波器、分光镜激发植物样品中各种发色团的动态荧光。样品激发出的荧光经显微镜放大后进行荧光光谱分析和荧光动力学成像分析。SM 9000光谱仪通过光纤与显微镜连接,以进行激发荧光光谱分析。安装在显微镜顶部的高分辨率CCD相机则用于荧光动力学成像分析。全部工作过程通过工作站和控制单元按照预先设定好的程序自动进行。测量过程中,可通过温控模块调控藻类、植物细胞等实验样品的温度。蠕动泵可以实现培养藻类的连续测量。
 仪器组成
仪器组成
1. 增强显微镜
2. 高分辨率CCD相机
3. 激发光源组
4. SM 9000光谱仪
5. 主控制单元
6. 工作站及软件
7. 控温模块的控制单元
8. 6位滤波轮

技术参数
· 测量参数
ú Fo, Fo’, Fs, Fm, Fm’, Fp, FtDn, FtLn, Fv, Fv'/ Fm', Fv/ Fm ,Fv',Ft,ΦPSII, NPQ_Dn, NPQ_Ln, Qp_Dn, Qp_Ln, qN, qP,QY, QY_Ln, Rfd, ETR等50多个叶绿素荧光参数,每个参数均可显示2维荧光彩色图像
ú OJIP快速荧光曲线:测定分析OJIP曲线与二十几项相关参数包括:Fo、Fj、Fi、P或Fm、Vj、Vi、Mo、Area 、Fix Area、Sm 、Ss 、N(QA还原周转数量)、Phi_Po 、Psi_o 、Phi_Eo、Phi_Do、Phi_pav、ABS/RC(单位反应中心的吸收光量子通量)、TRo/RC(单位反应中心初始捕获光量子通量)、ETo/RC(单位反应中心初始电子传递光量子通量)、DIo/RC(单位反应中心能量散失)、ABS/CS(单位样品截面的吸收光量子通量)、TRo/CSo、RC/CSx(反应中心密度)、PIABS(基于吸收光量子通量的“性能”指数或称生存指数)、PIcs(基于截面的“性能”指数或称生存指数)等(选配)
ú GFP、DAPI、DiBAC4、SYTOX、CTC等荧光蛋白和荧光染料的成像分析(选配)
ú QA再氧化动力学曲线(选配)
ú Spectrum荧光光谱图(选配)
· 具备完备的自动测量程序(protocol),可自由对自动测量程序进行编辑
ú Fv/Fm:测量参数包括Fo,Fm,Fv,QY等
ú Kautsky诱导效应:Fo,Fp,Fv,Ft_Lss,QY,Rfd等荧光参数
ú 荧光淬灭分析:Fo,Fm,Fp,Fs,Fv,QY,ΦII,NPQ,Qp,Rfd,qL等50多个参数,2套制式程序
ú 光响应曲线LC:Fo,Fm,QY,QY_Ln,ETR等荧光参数
ú Dyes & FPs稳态荧光成像测量
ú OJIP快速荧光动力学分析:Mo(OJIP曲线初始斜率)、OJIP固定面积、Sm(对关闭所有光反应中心所需能量的量度)、QY、PI等26个参数(选配)
ú QA再氧化动力学(选配)
ú Spectrum荧光光谱分析(选配)
· 荧光激发光源:红外光、红光、橙光、蓝光、绿光、白光、紫外光等可选,根据客户要求定制光源组
· 透射光源(选配):白光、远红光
§ 高分辨率TOMI-2 CCD传感器:
ú 逐行扫描CCD
ú 图像分辨率:1360×1024像素
ú 时间分辨率:在图像分辨率下可达每秒20帧
ú A/D 转换分辨率:16位(65536灰度色阶)
ú 像元尺寸:6.45µm×6.45µm
ú 运行模式:1)动态视频模式,用于叶绿素荧光参数测量;2)快照模式,用于GFP等荧光蛋白和荧光染料测量
ú 通讯模式:千兆以太网
显微镜:Axio Imager M2,可选配Axio Scope A1简洁版或Axio Imager Z2版
ú 物镜转盘:研究级7孔自动物镜转盘
ú 
 透射光快门
透射光快门
ú 聚光器 Achr Apl 0.9 H
ú 6位反光镜转盘
ú 双目镜筒(100:0/30:70/0:100)
ú 机械载物台:75×50mm,硬膜阳极氧化表面
ú 样品架:76×26mm
· 物镜:10倍、20倍、40倍、63倍和100倍专用生物荧光物镜(可选)
· 6位滤波轮:叶绿素荧光、GFP/SYTOX、DAPI/CTC等
· SM9000光谱仪
ú 入射狭缝:70µm×1400µm
ú 光栅:平场型校正
ú 光谱范围:200-980nm
ú 波长精确度:<0.5nm
ú 再现性:<0.1nm
ú 温度漂移:<0.01nm/K
· 温度调控模块:温度调节范围 5℃-70℃,精确度0.1℃
· 蠕动泵(选配):流速10-5600µl/min,用于藻类连续培养测量
FluorCam叶绿素荧光成像分析软件功能:具Live(实况测试)、Protocols(实验程序选择定制)、Pre–processing(成像预处理)、Result(成像分析结果)等功能菜单
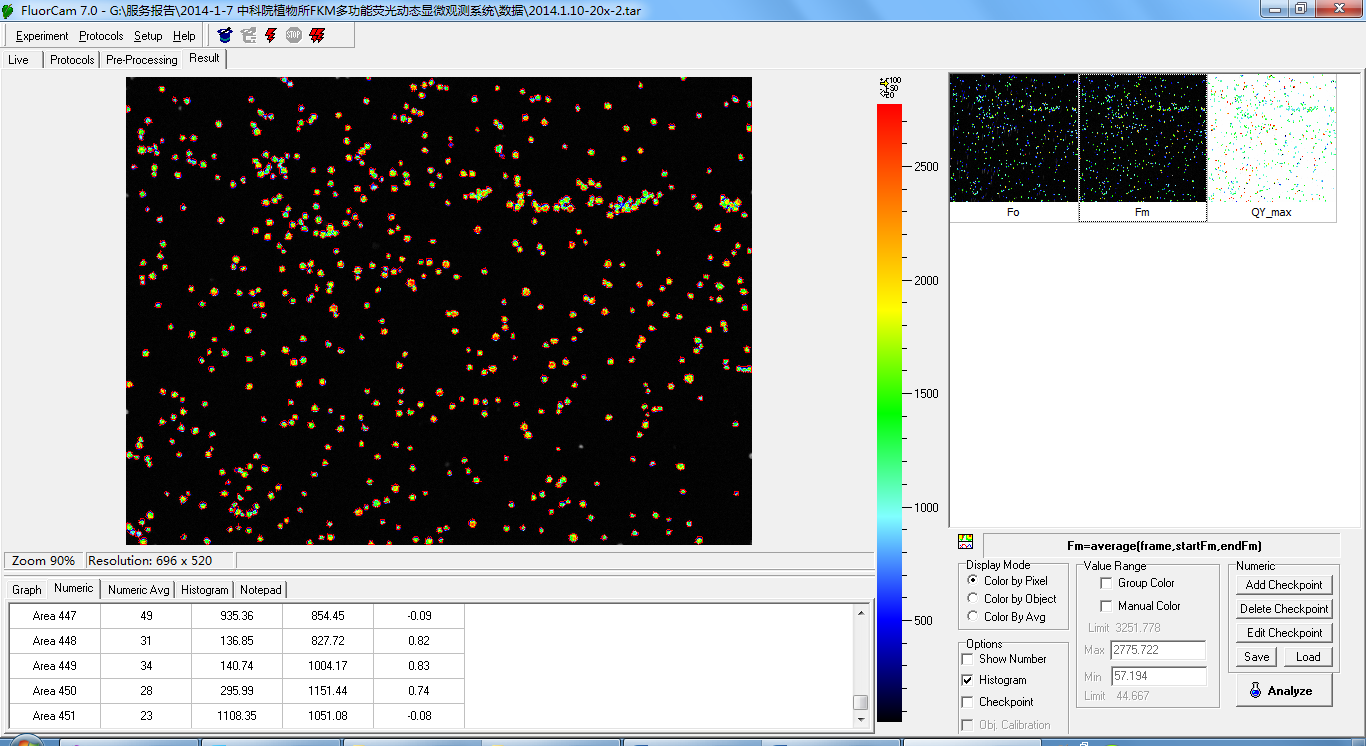

客户定制实验程序协议(protocols):可设定时间(如测量光持续时间、光化学光持续时间、测量时间等)、光强(如不同光质光化学光强度、饱和光闪强度、调制测量光等),具备专用实验程序语言和脚本,用户也可利用Protocol菜单中的向导程序模版自由创建新的实验程序
自动测量分析功能:可设置一个实验程序(Protocol)自动无人值守循环成像测量,重复次数及间隔时间客户自定义,成像测量数据自动按时间日期存入计算机(带时间戳)
快照(snapshot)模式:通过快照成像模式,可以自由调节光强、快门时间及灵敏度得到清晰突出的植物样本稳态荧光和瞬时荧光图片
成像预处理:程序软件可自动识别多个植物样品或多个区域,也可手动选择区域(Region of interest,ROI)。手动选区的形状可以是方形、圆形、任意多边形或扇形。软件可自动测量分析每个样品和选定区域的荧光动力学曲线及相应参数,样品或区域数量不受限制(>1000)
数据分析模式:具备“信号计算再平均”模式(算数平均值)和“信号平均再计算”模式,在高信噪比的情况下选用“信号计算再平均”模式,在低信噪比的情况下选择“信号平均再计算”模式以过滤掉噪音带来的误差
输出结果:高时间解析度荧光动态图、荧光动态变化视频、荧光参数Excel文件、直方图、不同参数成像图、不同ROI的荧光参数列表等
叶绿素荧光与光谱分析结果
| 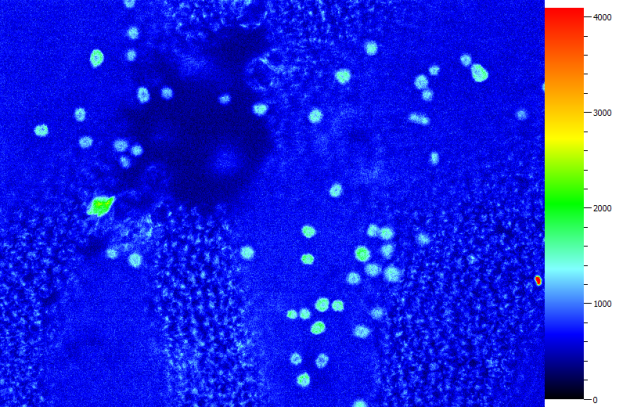 |
忍冬叶片横切荧光成像——栅栏组织和海绵组织 | 硅藻附生的紫菜表面荧光成像——细胞内的叶绿体分布 |
|
|
鸢尾表皮细胞荧光成像——气孔与叶绿体 | 衣藻荧光成像 |
|
|
玉米表皮细胞荧光成像 | 叶绿素荧光光谱分析 |
典型应用:
|
|
藻类病害(Gachon C, et al. 2006) | 藻类异形胞光合生理与变化过程 (Ferimazova N, et al. 2013) |
|
|
藻类特有不同光合色素蛋白复合体的荧光成像与分析(Andresen, et al. 2010) | 重金属胁迫对藻类/植物的影响(Thomas G, et al. 2016) |
|
|
蓝藻光合与固氮的时空隔离(Berman-Frank I, et al. 2001) | 植物/藻类光合作用机制的深入研究(Vacha F, et al. 2007.) |
|
|
单个细胞\叶绿体荧光动力学与表型分析(Jacobs M, et al. 2016.) | OJIP快速荧光曲线和QA再氧化动力学曲线测量 |
|
|
C4植物玉米花环结构光合特性分析 | 荧光蛋白与荧光染料显微成像 |
产地:捷克
参考文献:
1. Küpper H, et al. 2019. Analysis of OJIP Chlorophyll Fluorescence Kinetics and QA Reoxidation Kinetics by Direct Fast Imaging. Plant Physiology 179: 369-381
2. Konert G, et al. 2019. Protein arrangement factor: a new photosynthetic parameter characterizing the organization of thylakoid membrane proteins. Physiologia Plantarum 166: 264-277.
3. Exposito-Rodriguez M, et al. 2017. Photosynthesis-dependent H2O2 transfer from chloroplasts to nuclei provides a high-light signalling mechanism. Nature Communications, 8: 49
4. Higo S, et al. 2017. Application of a pulse-amplitude-modulation (PAM) fluorometer reveals its usefulness and robustness in the prediction of Karenia mikimotoi blooms: A case study in Sasebo Bay, Nagasaki, Japan. Harmful Algae, 61:63-70
5. Jacobs M, et al. 2016. Photonic multilayer structure of Begonia chloroplasts enhances photosynthetic efficiency. Nature Plants, doi:10.1038/nplants.2016.162
6. Andresen E, et al. 2016. Cadmium toxicity investigated at the physiological and biophysical levels under environmentally relevant conditions using the aquatic model plant Ceratophyllum demersum. New Phytol., 210(4):1244-1258
7. Thomas G, et al. 2016. Deficiency and toxicity of nanomolar copper in low irradiance—A physiological and metalloproteomic study in the aquatic plant Ceratophyllum demersum. Aquatic Toxicology, 177:226-236
8. Fujise L, et al. 2014. Moderate Thermal Stress Causes Active and Immediate Expulsion of Photosynthetically Damaged Zooxanthellae (Symbiodinium) from Corals. PLOS ONE, DOI:10.1371/journal.pone.0114321
9. Gorecka M, et al. 2014. Abscisic acid signalling determines susceptibility of bundle sheath cells to photoinhibition in high light-exposed Arabidopsis leaves. Philosophical Transactions of the Royal Society B, 369(1640), DOI: 10.1098/rstb.2013.0234
10. Mishra S, et al. 2014. A different sequence of events than previously reported leads to arsenic-induced damage in Ceratophyllum demersum L. Metallomics, 6: 444-454
11. Ferimazova N, et al. 2013. Regulation of photosynthesis during heterocyst differentiation in Anabaena sp. strain PCC 7120 investigated in vivo at single-cell level by chlorophyll fluorescence kinetic microscopy. Photosynthesis Research, 116(1): 79-91
12. Andresen E, et al. 2013. Effects of Cd & Ni toxicity to Ceratophyllum demersum under environmentally relevant conditions in soft & hard water including a German lake. Aquatic Toxicology. 142–143, 15: 387–402