PTM-48A植物生理生态监测系统
前言
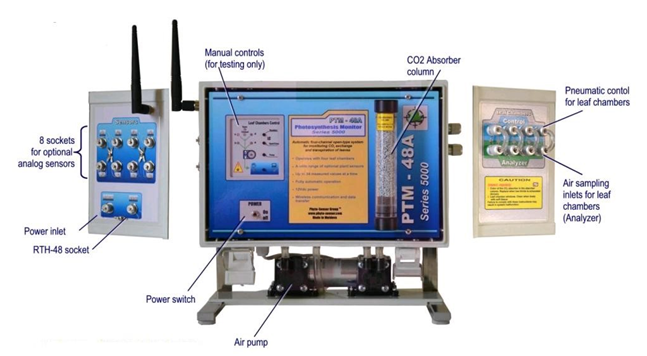
PTM-48A植物生理生态监测系统可长期、自动监测植物的光合速率、蒸腾速率,植物生理生长状态,环境因子,从而得到植物的全面的信息。系统具备4个自动开合的叶室,可在30秒内获得叶片的CO2、H2O交换速率。LC-4B透明叶室和LC-4D非透明叶室双叶室配合使用,则可研究植物的光呼吸、暗呼吸、总光合、净光合。系统还配备1个数字通道连接RTH-48传感器组合(可测定空气温、湿度、光合有效辐射、叶片湿度);8个模拟通道连接其他可选的植物生理指标监测传感器,还可同时配备FP100叶绿素荧光自动监测模块进行叶绿素荧光实时监测。系统通过RS-232 或RS-485端口与电脑通讯,也可选择2.4GHz无线通讯或GPRS实现无线通讯和网络化。

应用领域
应用于植物生理学、生态学、农学、园艺学、作物学、设施农业、节水农业等研究领域
进行不同物种、不同品种的差异比较
比较不同处理、不同栽培条件对植物的影响
研究植物光合、蒸腾、生长的限制因子
研究生长环境对植物的影响及植物对环境变化的响应
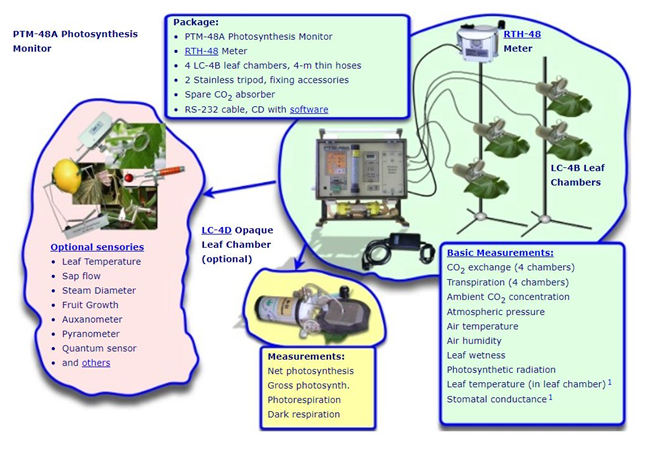

上图为主机配置各种传感器示意图
基本配置组成
PTM-48A系统控制台
LC-4B透明叶室×4,20 cm2
RTH-48测量仪
无线传输适配器
安装支架


上图左为透明叶室、非透明叶室对同一植物叶片净光合与暗呼吸连续监测图,右为中科院植物所PTM48A光合叶室实物图
技术指标
工作方式:自动持续测量
叶室取样时间:30s
CO2测量原理:无色散红外气体分析器
CO2浓度测量范围:0-1000 ppm
信号噪音:2 ppm pk-pk @ 350 ppm
CO2交换速率的额定测量范围:-70-70μmolCO2m-2s-1
蒸腾速率的额定测量范围:0-150 mgH2O m-2 s-1
叶室空气流速:0.9±0.1L/min,精度0.02 L/min
RTH-48 测量仪:温度0-50℃,分辨率0.1℃;相对湿度:0-RH,分辨率0.1%RH;光合有效辐射:0-2000µmolm-2s-1,分辨率15µmolm-2s-1
测量间隔:5-120分钟用户自定义
存储容量:1200条数据,采样频率为30分钟时可存储25天
连接管的标准长度:4m
模拟通道数量:8
电源:可选12VDC@60W,或220/110/100 VAC 50/60 Hz@150W,使用车载蓄电池可持续工作16天以上
通讯方式:RS232 和RS485 (内置/可选),无线MODEM或GPRS
环境防护级别:IP55
可选配叶室和传感器
1. LC-4W 透明叶室,矩形叶室,13×77mm,10cm2,空气流速0.45±0.05L/min
2. LC-4WD 非透明叶室,矩形叶室,13×77mm,10cm2,空气流速0.23±0.05L/min
3. LC-4D非透明叶室,空气流速0.45±0.05L/min
4. FP100叶绿素荧光自动监测模块,可自动监测Ft、QY等叶绿素荧光参数
5. SD-5P 茎杆微变化传感器:线性测量范围0-5000μm,分辨率0.002mm,适用于5-25mm直径茎杆
6. SD-6P 茎杆微变化传感器:线性测量范围0-5000μm,分辨率0.002mm,适用于2-7cm直径茎杆
7. DE-1P 树干生长传感器:线性测量范围0-10mm,分辨率0.005mm,适用于直径6cm以上树干
8. FI-LP 大果实生长传感器:测量范围:30-160 mm,分辨率0.065mm
9. FI-MP 中果实生长传感器:测量范围15-90 mm,分辨率0.038mm
10. FI-SP 小果实生长传感器:测量范围7-45 mm,分辨率0.019mm
11. FI-XSP 微小果实生长传感器:测量范围4-30 mm,分辨率0.005mm
12. LT-LC叶温传感器:选配该传感器后,系统可以得到叶片的气孔导度数据。测量范围5-50℃,精度<0.15℃
13. LT-1P 叶面温度传感器:测量范围5-50℃,精度<0.15℃
14. LT-IRP 红外叶温传感器:红外原理,无接触测量叶片温度,测量范围0-50℃,精度±1℃,重复性±0.1℃
15. SF-4P 植物茎流传感器:3ml/h,适用于直径1-5mm茎杆
16. SF-5P 植物茎流传感器:3ml/h,适用于直径4-8mm茎杆
17. SA-20P 株高传感器:测量范围0-2000 mm,分辨率2mm
18. TIR-4P 总辐射传感器:0-1000 W/m2 ,精度±10%,重复性±1%
19. PIR-1P 光合有效辐射传感器:测量范围0 -2500 µmol/m2s,精度±5%,重复性±1%
20. SMS-5P 土壤水分传感器:测量范围0-100 vol%,精度±3%,分辨率0.1%
21. LWS-02P 叶片湿度传感器:叶片模拟器,输出电压值,与叶片湿度成正比,反映叶片表面的干湿状况
22. ST-21P 土壤温度传感器:测量范围0-50℃,精度<0.15℃
23. SMTE/SMTE-2 土壤水分、温度、电导率三参数传感器:水分测量范围0-100 vol%,精度±3%,分辨率0.1%;温度测量范围-40-50℃,精度±1℃,分辨率0.1℃;电导率测量范围:0-15dS/m,分辨率0.01dS/m,精度±10%
注:每种传感器都配有4米缆线。
软件界面与数据


应用案例
Net CO2 uptake rates for Hylocereusundatus and Selenicereusmegalanthus under field conditions: Drought influence and a novel method for analyzing temperature dependence, Ben –Asher. J. et al. 2006, Photosynthetica, 44(2): 181-186
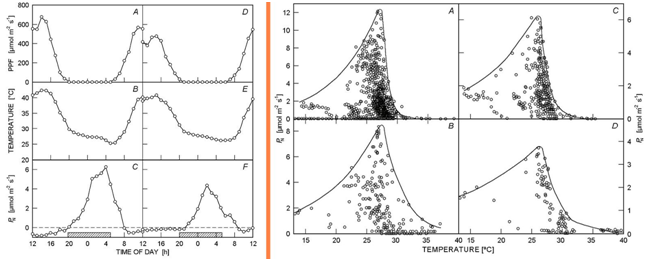

本研究测量量天尺(Hylocereusundatus,果实为火龙果)和蛇鞭柱(Selenicereusmegalanthus)在高温下CO2吸收率的变化,并分析了其生理生化变化。
产地
以色列
选配技术方案
1) 与叶绿素荧光仪组成光合作用与叶绿素荧光测量系统
2) 与FluorCam联用组成光合作用与叶绿素荧光成像测量系统
3) 可选配高光谱成像实现从单叶片到复合冠层的光合作用时空变化研究
4) 可选配O2测量单元
5) 可选配红外热成像单元以分析气孔导度动态
6) 可选配PSI智能LED光源
7) 可选配FluorPen、SpectraPen、PlantPen等手持式植物(叶片)测量仪器,全面分析植物叶片生理生态
8) 可选配ECODRONE®无人机平台搭载高光谱和红外热成像传感器进行时空格局调查研究
部分参考文献
1. 宋宗河, 郑文寅&张学昆. 甘蓝型油菜耐旱相关性状的主成分分析及综合评价. 中国农业科学 44, 1775–1787 (2011).
2. 李婷婷, 江朝晖, 闵文芳, 姜贯杨&饶元. 基于基因表达式编程的番茄叶片CO2交换率建模与预测. 浙江农业学报 28, 1616–1623 (2016).
3. Ton, Y. ADVANTAGES OF THE CONTINUOUS AROUND-THE-CLOCK MONITORING OF THE LEAF CO2 EXCHANGE IN PLANT RESEARCH AND IN CROP GROWING. 5
4. Jiang, Z. H., Zhang, J., Yang, C. H., Rao, Y. & Li, S. W. Comparison and Verification of Methods for Multivariate Statistical Analysis and Regression in Crop Modelling. in Proceedings of the 2015 International Conference on Electrical, Automation and Mechanical Engineering (Atlantis Press, 2015). doi:10.2991/eame-15.2015.163
5. Ben-Asher, J., Garcia y Garcia, A. &Hoogenboom, G. Effect of high temperature on photosynthesis and transpiration of sweet corn (Zea mays L. var. rugosa). Photosynthetica 46, 595–603 (2008).
6. Schmidt, U., Huber, C. &Rocksch, T. EVALUATION OF COMBINED APPLICATION OF FOG SYSTEM AND CO2 ENRICHMENT IN GREENHOUSES BY USING PHYTOMONITORING DATA. Acta Horticulturae 1301–1308 (2008).
7. Qian, T. et al. Influence of temperature and light gradient on leaf arrangement and geometry in cucumber canopies: Structural phenotyping analysis and modelling. Information Processing in Agriculture (2018). doi:10.1016/j.inpa.2018.11.002
8. Uwe Schmidt, Ingo Schuch, Dennis Dannehl, Thorsten Rocksch& Sonja Javernik. Micro climate control in greenhouses based on phytomonitoring data.pdf.
9. Turgeman, T. et al. Mycorrhizal association between the desert truffle Terfeziaboudieri and Helianthemum sessiliflorum alters plant physiology and fitness to arid conditions. Mycorrhiza 21, 623–630 (2011).
10. Ben-Asher, J., Nobel, P. S., Yossov, E. & Mizrahi, Y. Net CO2 uptake rates for Hylocereusundatus and Selenicereusmegalanthus under field conditions: Drought influence and a novel method for analyzing temperature dependence. Photosynthetica 44, 181–186 (2006).
11. Zhaohui, J., Jing, Z., Chunhe, Y., Yuan, R. &Shaowen, L. Performance of classic multiple factor analysis and model fitting in crop modeling. Biol Eng 9, 8
12. Ojha, T., Misra, S. &Raghuwanshi, N. S. Wireless sensor networks for agriculture: The state-of-the-art in practice and future challenges. Computers and Electronics in Agriculture 118, 66–84 (2015).