FluorCam多光谱荧光成像系统
FluorCam多光谱荧光成像系统是FluorCam叶绿素荧光成像技术的扩展产品,既可用于叶绿素荧光动态成像分析,又可用于长波段UV紫外光(320nm-400nm)对植物叶片激发产生的多光谱荧光成像测量分析,还可选配绿色荧光蛋白GFP等稳态荧光的成像测量。标准配置(标准版)的成像面积为13 x 13 cm ,大型版成像面积达20 x 20 cm ,广泛应用于植物光合生理生态、植物逆境胁迫生理与易感性、气孔功能、植物环境如土壤重金属污染响应与生物检测、植物抗性、作物育种、Phenotyping、转基因、稳态荧光成像测量等研究。

功能特点:
ü 多激发光-多光谱荧光成像技术:通过光学滤波器技术,仅使特定波长的光(激发光)到达样品以激发荧光,同时仅使特定波长的激发荧光到达检测器。不同的荧光发色团(如叶绿素或GFP绿色荧光蛋白等)对不同波长的激发光“敏感”并吸收后激发出不同波长的荧光,根据此原理可以选配2个或2个以上的激发光源、绿波轮及相应滤波器,对不同波长荧光(多光谱荧光)进行成像分析。如选配红光和兰光及相应滤波器,可以对GFP和叶绿素荧光成像分析,还可选配绿色光源及相应滤波器,以对YFP进行荧光成像分析等;
ü UV紫外光激发多光谱荧光成像技术:长波段UV紫外光(320nm-400nm)对植物叶片激发,可以产生具有4个特征性波峰的荧光光谱,4个波峰的波长为兰光440nm(F440)、绿光520nm(F520)、红光690nm(F690)和远红外740nm(F740),其中F440和F520统称为BGF,由表皮及叶肉细胞壁和叶脉发出,F690和F740为叶绿素荧光Chl-F。紫外光激发多光谱荧光可以用来灵敏、特异性地评估植物生理状态包括受胁迫状态,包括干旱、病虫害、环境污染、氮胁迫等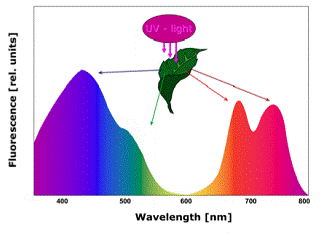
ü 成像面积大,标准配置为13x13cm,大型版成像面积达20x20cm,可对整株植物甚至多株植物(如拟兰芥等小型植物)进行实验成像分析
ü 可进行自动重复成像测量和无人值守监测,可设置两个实验程序(Protocols)自动循环成像测量,成像测量数据自动按时间日期存入计算机(带时间戳)
ü 带有Kautsky诱导效应、荧光淬灭分析、GFP稳态荧光成像及紫外光激发多光谱荧光成像分析等各种通用实验程序(protocols),测量分析参数达60多个
ü 可选配TetraCam彩色成像模块,成像面积20x25cm,用于形态测量分析,结合荧光成像分析参数,可作为植物表型分析(Phenotyping)的有力工具
ü 测量样品包括叶片、花卉、果实、根系、植物其它组织及整株植物、藻类、小型动物等
配置规格:
1) 标准配置:可进行叶绿素荧光成像分析及UV紫外光源激发4个波段的荧光成像分析,成像面积13 x 13cm,系统高度集成、方便使用,具备7位绿波轮及多光谱荧光成像滤波器组、高分辨率CCD镜头、UV紫外光激发多光谱荧光成像功能模块及程序软件等;
2) 扩展配置:模块式结构,具备高度可扩展性,不仅可进行叶绿素荧光成像分析及UV紫外光源激发4个波段的荧光成像分析,还可进行PAR吸收及NDVI成像分析、GFP绿色荧光蛋白等稳态荧光成像分析(选配),可根据客户需求选配不同的激发光源和滤波器组合,成像面积13 x 13cm;
3) 大型配置:具备上述扩展配置的所有功能优势,成像面积达20cm x 20cm,可对整株植物或多株植物进行成像分析。
技术指标:
® 标准版成像面积达13x13cm,大型版成像面积达20x20cm
® 标准配置含滤波轮、ChlF.滤波器及高分辨率镜头,测量参数包括Fo, Fo’, Fs, Fm, Fm’, Fp, FtDn, FtLn, Fv, NPQ_Dn, NPQ_Ln, Qp_Dn, Qp_Ln, qN, QY, QY_Ln, PARabs, Rfd,BGF,UV-Chl.F等60多个叶绿素荧光参数和稳态荧光
® 紫外光激发多光谱荧光参数包括F440、F520、F690、F740
® 高分辨率CCD镜头,1392x1040像素,有效像素大小为6.45μm,高速USB 2.0 (480Mbits/sec),可像素叠加(binning)以提高灵敏度(2x2,3x3,4x4)
® 自动测量分析功能(无人值守):可预设1个或2个试验程序,系统可自动测量储存,比如白天自动定时运行Kautsky诱导效应程序,夜间自动定时运行荧光淬灭分析程序
® 配置有通用叶绿素荧光成像测量实验程序(protocols)和稳态荧光测量程序(选配),包括Fv/Fm Protocol,Kautsky诱导效应Protocol,荧光淬灭分析 Protocol,稳态荧光测量,客户定制光响应曲线及PAR吸收成像测量等
® 4个13x13cmLED光源板(大型版为20x20cm),双色光源(2红橙光+2蓝光),双色光化学光(Actinic light1和Actinic light2)
® 标配Actinic1光强300μmol(photons)/m2.s ,Actinic2光强2000μmol(photons)/m2.s,饱和光闪4000μmol(photons)/m2.s
® 光源升级:Actinic1光强2000μmol(photons)/m2.s ,Actinic2光强3000μmol(photons)/m2.s,饱和光闪6000μmol(photons)/m2.s
® 标配测量光为618nm红光,其它波段可选,持续时间10μs - 100μs可调;
® 7为滤波轮及滤波器,用于成像测量叶绿素荧光、F440、F520、F690、F740及GFP等稳态荧光(GFP荧光需选配相应功能模块)
® 可选配远红光735nm(FAR)与630nm双色LEDs光源板及相应滤波器和功能程序模块,用于测量Fo’、PARabs及NDVI
® 可选配1对青色LEDs光源板及相应滤波器等,光强3000μmol(photons)/m2.s,用于气孔功能测量研究
® 可选配1对绿色LEDs光源板用于测量YFG(须选配相应滤波器等)
® 如测量其它荧光参数,须选配相应滤波器等(请咨询EcoLab实验室),以下为选配参考:
® FluorCam叶绿素荧光成像分析软件,具Live(实况测试)、Protocol(实验程序选择)、Pre-processing(成像预处理)、Result(成像分析结果)等菜单
® Protocol实验程序可自由编辑,也可利用Protocol菜单中的向导程序模版客户自由创建新的实验程序
® 成像预处理可以自动选区或手动选择不同形状、不同数量、不同位置的区域(Region of interest,ROI),成像分析结果包括高时间解析度荧光动态图、直方图、不同参数成像图、不同ROI的荧光参数列表等
® 数据分析具备“信号计算再平均”模式(算数平均值)和“信号平均再计算模式”,在高信噪比的情况下选用“信号计算再平均”模式,在低信噪比的情况下选择“信号平均再计算”模式以过滤掉噪音带来的误差
® 给光制度:静态或动态(窦式)
® A/D 转换分辨率:12 位;Bios:固件可升级
® 通讯方式:USB 2.0
® 供电电压:90 – 240 V
下图为植物接种病毒(PMMoV-I为意大利菌株,PMMoV-S为西班牙菌株)后(dpi为接种后的侵染天数)的紫外光激发多光谱荧光成像,其中Abaxial为叶片背面成像,Adaxial为叶片正面成像(引自Monica Pineda等,2008)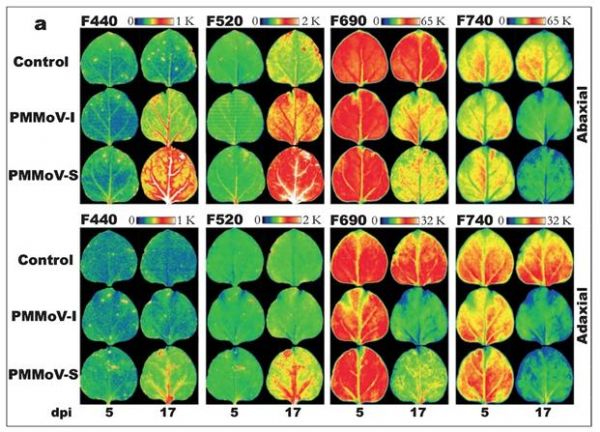
产地:欧洲