水体富营养化在线观测预报系统
水体富营养化(eutrophication)是指由于人类活动的影响,导致大量外源氮、磷等营养物质进入湖泊、河口、海湾等缓流水体,引起藻类及其他浮游生物迅速繁殖,水体溶解氧量下降,水质恶化,鱼类及其他生物大量死亡的现象。当总磷浓度超过0.1mg/l(如果磷是限制因素)或总氮浓度超过0.3mg/l(如果氮是限制因素)时,藻类会过量繁殖。经济合作与发展组织(OECD)提出富营养湖的几项指标量为:平均总磷浓度大于0.035mg/l;平均叶绿素浓度大于0.008mg/l;平均透明度小于3m。目前一般采用的指标是:水体中氮含量超过0.2-0.3ppm,生化需氧量大于10ppm,磷含量大于0.01-0.02ppm,pH值7-9的淡水中细菌总数每毫升超过10万个,表征藻类数量的叶绿素-a含量大于10μmg/L。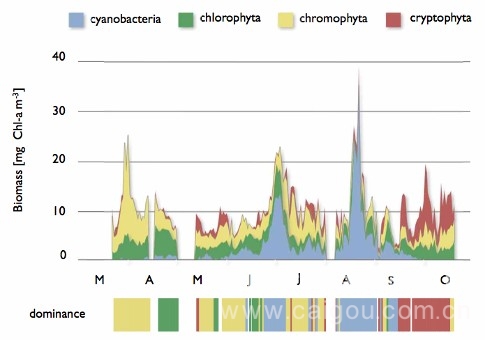
水体富营养化在线观测预报系统由藻类在线观测模块、氮磷在线观测模块、水体呼吸在线观测模块及污染源荧光示踪仪组成,可在线监测藻类浓度动态变化及生态生理状况、总氮总磷及营养盐动态变化、溶解氧动态变化及BOD等,并通过移动式荧光示踪测量仪观测分析藻类的空间分布状况、荧光示踪测量分析污染源分布和时空变化等,全面监测和解析富营养化的时空动态变化及来源,即时作出预测预报及相应防治对策。
藻类在线观测模块采用叶绿素荧光技术(Technique of chlorophyll fluorescence)原理和叶绿素延迟荧光技术(Delayed fluorescence technique)原理。前者通过脉冲调制荧光方法(Pulse amplitude modulated (PAM)fluorescence methods),利用调制测量光、持续光化学光及饱和光闪激发叶绿素荧光,测量分析Ft、QY及OJIP等快速荧光参数,以研究藻类及高等植物的光合生理生态和胁迫生理,如不同除藻剂及不同剂量的QY和OJIP变化,以便找出除藻剂有效剂量及无污染除藻剂技术,其中Ft、OJIP固定面积(Fix-area,指OJIP曲线下面的面积)与藻类叶绿素浓度呈相关关系,经校准可以测量藻类密度(藻类叶绿素浓度);延迟荧光是比快速荧光弱但持续时间更长的叶绿素荧光,浮游植物延迟荧光与活体藻类浓度相关,不同颜色藻类可以激发出不同的延迟荧光,依次可以区分不同藻类的浓度,达到定性、定量监测藻类的目的。水体富营养化在线观测预报系统使用公认的实验室湿化学分光光度法进行样品分析,水体呼吸采用“间歇式”测量原理,集合了“开放式”(实时测量)和“封闭式”(测量简单但精度差)的优点,同时又克服了开放式测量时间解析度差、封闭式不能连续长时间测量等缺点,利用光纤荧光氧气测量技术,在线测量观测溶解氧及水体呼吸并可求出BOD等。
水体富营养化在线观测预报系统主要功能特点如下:
1. 可在线分类定量监测蓝藻和绿藻等其它藻类的动态变化
2. 在线监测光谱性藻类的叶绿素荧光参数Ft、QY及OJIP-fix area,从而可全面分析藻类的光合生理状况、胁迫状况、生长状况及浓度状况
3. 在线分析总氮、总磷,并进一步监测分析各组分包括磷酸盐、氨氮、亚硝态氮、硝态氮的动态变化
4. 在线监测分析水体溶解氧变化、水体呼吸及BOD状况
5. 各监测模块自由组合,又可独立运行
6. 利用荧光示踪技术,可追踪污染源的空间分布状况,可用于地表水污染状况分布图绘制、污染状况监测研究、污染源追踪等
性能指标
1. 高灵敏度在线监测广谱藻类叶绿素荧光特性包括Ft、QY和OJIP-Fix area等,检测极限达30ng Chl/l,可检测出10 cells/ml的绿藻或100 cell/ml的蓝藻。蓝色(455nm)和红色(630nm)双色测量光,可选配其它波长测量光
2. 延迟荧光技术分类定量监测蓝藻、绿藻(包括绿藻、裸藻等)、硅藻(包括硅藻、金藻、黄藻等)和隐藻类4种藻类,可通过USB接口下载数据或通过网络远程数据下载和数据诊断
3. 在线测量监测总磷、磷酸盐、总氮、氨氮、硝态氮和亚硝态氮的动态变化,超量程自动稀释;标准检测范围:
a) 总磷:0-3ppm-200ppm-P
b) 总氮:0-5 ppm - 1000 ppm – N
c) 氨氮:0-0.2 ppm - 200 ppm - N-NH3
d) 硝酸盐+亚硝酸盐:0-5 ppm - 1000 ppm - N-NO3
e) 亚硝酸盐:0-0.05 ppm - 20 ppm - N-NO2
f) 磷酸盐:0-0.2 ppm - 200 ppm - P-PO4
4. 营养盐测量方式为循环顺序测量,测量间隔程序可调
5. 具备试剂冷藏配置,试剂更换3-6周(取决于测量参数及方法等因素)
6. 内置时钟和显示屏,在线显示和存储数据包括日期、时间及测量值等
7. Mini型荧光光纤氧传感器, Mini光纤氧探头外径2.8mm,内径2.0mm,被覆有光隔离材料以避免生物自发光造成的干扰,因而可以测量藻类等(有叶绿素荧光)具有内部自发光的生物耗氧;零氧耗、高稳定性,响应时间快于6秒(气相测量);可测量液相和气相氧浓度,测量范围0-50%空气氧、0 - 22.5 mg/L,测量极限0.15 %空气氧、15 ppb溶解氧;氧浓度在线温度补偿,不受电磁信号干扰
8. 污染源荧光示踪仪为带参考光束的90度滤波式荧光仪,光源、检测器内置用户自定义设置的光学滤波器,多广谱测量,适于叶绿素荧光和其它示踪荧光如荧光素(光源465nm,检测器530nm)、若丹明(光源530nm,检测器580nm)等;测量单位:ppt,ppb,μg/l,μmol等,或者任意单位,灵敏度Chla 0.025μg/l
9. 防水级别:IP65
国内外应用状况
藻类荧光技术应用于水体藻类监测包括水华监测预报及藻类生理生态和防治研究,近些年来在国际上得到越来越广泛的重视和应用,成为评估水体生态系统的重要技术手段和研究领域,对水生态评估和研究具有划时代意义。Dijkman等(1999)利用双调制荧光仪可以检测到100pM(皮摩尔浓度)叶绿素浓度的藻类。Vera Istvanovics 等(2005)利用延迟荧光技术对匈牙利Balaton湖浮游植物进行了持续在线监测,结果表明延迟荧光数据与传统显微镜计数法及实验室叶绿素浓度测量法具有极高的吻合性,可以精确监测不同藻类的浓度,检测极限约为1μg Chl/l。Gabriel等(2006)以Ft作为藻类叶绿素浓度指标、QY(Fv/Fm)作为藻类光合效率指标,研究了哥伦比亚安第斯高山带湖泊藻类动态,结果显示6月份深水层藻类叶绿素浓度高但光合效率低,而10月份水体循环期,藻类叶绿素浓度低但光合效率高,藻类光合效率并不依赖于生物量,而是与营养可获得性及光辐射情况有关。2007年,届“叶绿素荧光技术与水科学”(Aquafluo 2007: chlorophyll fluorescence in aquatic sciences)国际会议在捷克召开;2010年,《Chlorophyll Fluorescence in Aquatic Sciences: Methods and Applications》(David J.Suggett等,2010)一书正式出版,该书全面介绍了荧光技术包括延迟荧光技术在水体藻类监测、研究、水体生产力评估等方面方法、技术和应用等。
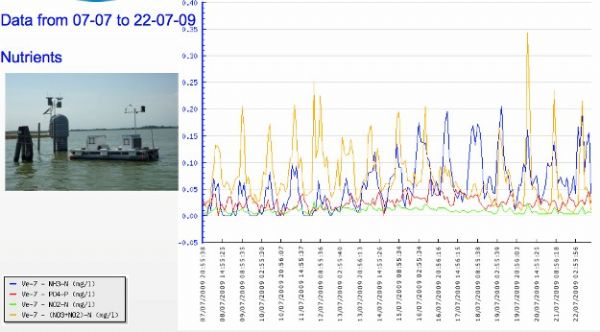
我国营养盐测量监测多采取采样实验室分析的方法(刘信安等,2005;李哲等,2009;),与实验室分析相比,原地(in-situ)在线监测具有即时(real-time)持续监测动态变化等无可比拟的优点,而且可以与藻类在线监测等数据耦合分析,因此成为国际研究的热点。欧盟于2007年启动了WARMER 项目(Water Risk Management in EuRope),其目标为在海滨地带及大江大湖区建立一个水质即时(real-time)监测系统,作为本项目的内容,Gunatilaka等(2009)利用原位监测技术,对威尼斯泻湖磷酸盐、铵态氮、硝态氮和亚硝态氮进行了监测,监测结果比起抽样实验室分析法(如每周或每月抽样)更精确系统地反映了营养盐的日变化、月变化等动态。
参考文献:
1. Kijkman,N., D. Kaftan and M. Trtilek. Measurements of phytoplankton of sub-nanomolar chlorophyll concentrations by a modified double-modulation fluorometer. Photosynthetica, 37(2): 249-254, 1999
2. Istvanovics, Vera, Mark Honti, Andras Osztoics, etc. Continuors monitoring of phytoplankton dynamics in Lake Balaton (Hungary) using on-line delayed fluorescence excitation spectroscopy. Freshwater Biology, 50: 1950-1970, 2005
3. Gabriel A., John C. and Carlos A. Photosynthetic efficiency of Phytoplankton in a Tropical Mountain Lake. Caldasia 28(1): 57-66, 2006
4. Prasil O, Suggett D J, Cullen JJ, etc. Aquafluo 2007: chlorophyll fluorescence in aquatic sciences, an international conference held in Nove ® Hrady. Photosynth Res. 95(1): 111-115, 2008
5. David J., Borowitzka, Michael A, etc. Chlorophyll a Fluorescence in Aquatic Sciences: Methods and Applications. Springer Dordrecht Heidelberg London New York, 2010.
6. Gunatilaka, A., P. Moscetta, L. Sanfilippo, etc. Observations on Continuous Nutrient Monitoring in Venice Lagoon. IEEE Oceans’09 conference, Biloxi(USA), 26-29, 2009
7. Moscetta, P., L. Sanfilippo, E. Savino, etc. Instrumentation for continuous monitoring in marine environment. IEEE Oceans’09 conference. Biloxi(USA), 2009
8. 李哲、方芳、郭劲松等,三峡小江回水段2007年春季水华与营养盐特征。湖泊科学,21(1):36-44,2009
9. 刘信安、湛敏、马艳娥,三峡库区流域藻类生长与营养盐吸收关系。环境科学,26(4):95-99,2005