科研前线│Cell│氧电极]硅藻蛋白核被蛋白质外壳包裹从而高效固定CO2
Pyrenoid-蛋白核(造粉核、淀粉核),某些藻类植物载色体上的一种特殊结构,在绿藻中较常见。高等植物中除了角苔纲以外其他均没有。一个蛋白质的核心部分,外围以若干淀粉小块,这是藻类植物蛋白质与淀粉的一种贮藏形态。之前,人们一直认为藻类蛋白核分为2种:1、具鞘蛋白核(有淀粉鞘);2、裸蛋白核。

近日,日本关西学院大学(KwanseiGakuinUniversity)生物与环境科学学院生物科学系YusukeMatsuda课题组联合瑞士巴塞尔大学生物中心(TheUniversityofBasel’sBiozentrum)BenjaminD.Engel等多家研究机构,在Cell上发表了题为“Diatom pyrenoids are encased in a protein shell that enables efficient CO2fixation”的研究性论文,该研究首次发现了第3种藻类蛋白核类型——具鞘蛋白核(PyShell),并分析了硅藻蛋白核PyShell的结构和功能,阐述了它在Rubisco有效催化CO₂固定中的贡献,为研究海洋生态系统中CO₂的同化途径提供了重要参考。
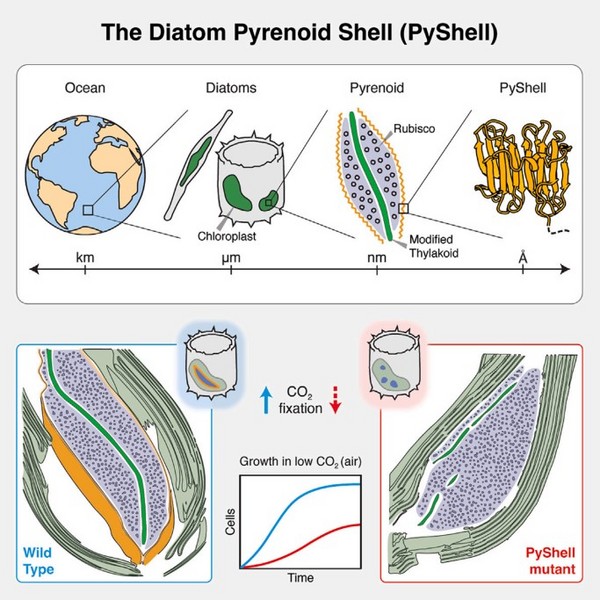
图1硅藻细胞蛋白核PyShell蛋白示意图
蛋白核的中心部分穿透类木质膜,其膜腔中特异性存在碳酸酐酶(CA)。研究认为,CA能使硅藻通过从海水中吸收并储存在叶绿体中的HCO3-快速转化成CO₂,为聚合在蛋白核中的Rubisco提供CO₂(图1)。然而,由于蛋白核难以分离,其成分和功能并不为人所熟知。
研究团队进行了硅藻PyShell蛋白的鉴定及定位,并解析了硅藻细胞中PyShell蛋白的分子结构。此外,研究人员还利用冷冻电子断层扫描技术详细观察了硅藻内部的微细结构。
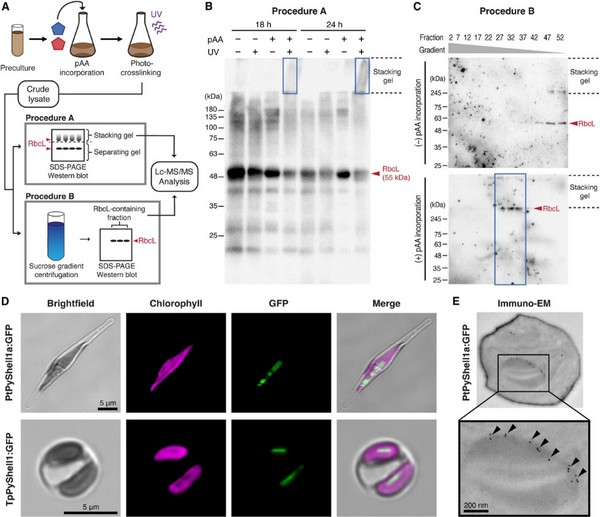
图2硅藻中PyShell蛋白的鉴定
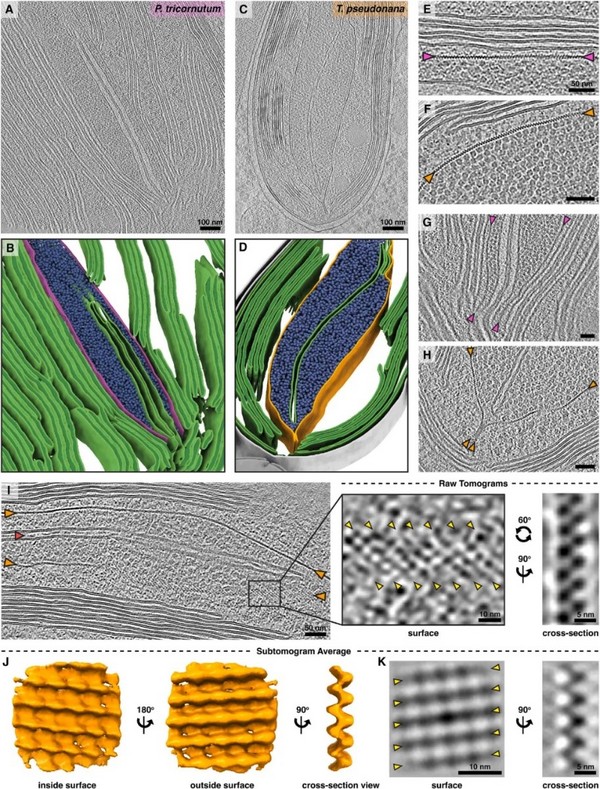
图3硅藻细胞中PyShell蛋白的原位冷冻电镜断层扫描图像
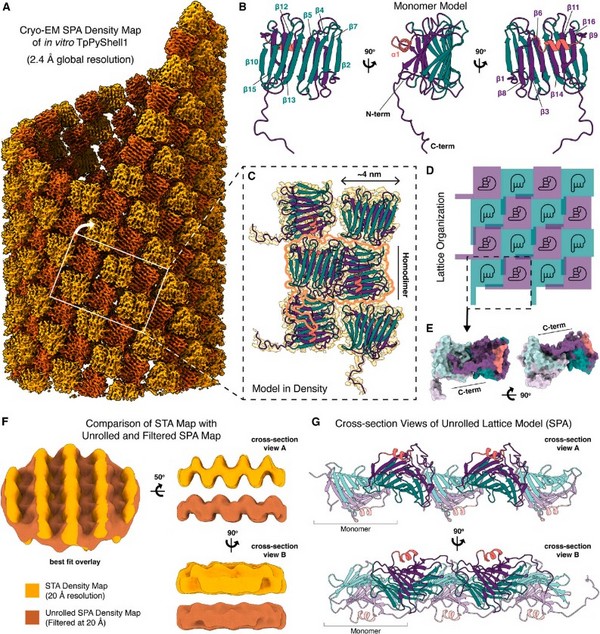
图4T.pseudonanaPyShell蛋白体外结构示意图
通过基因组编辑技术破坏硅藻的PyShell基因后,这些基因被破坏的硅藻在空气环境的生长速度显著变慢,光合作用效率显著降低,仅为野生菌株的1/80(图5)。在向反应体系中逐步加入NaHCO3的过程中,通过液相氧电极(Hansatech,King'sLynn,U.K.)和气相色谱火焰离子化检测器同时测量硅藻(WT、m1和m2)样品混合物中净O₂的释放速率和DIC的总浓度。根据O₂释放速率与DIC浓度的关系曲线计算光合作用参数:Pmax,最大净O₂释放速率;K0.5,Pmax的一半时DIC浓度;[DIC]comp,无净O₂释放时DIC浓度;APC,表观光合传导率(表1)。
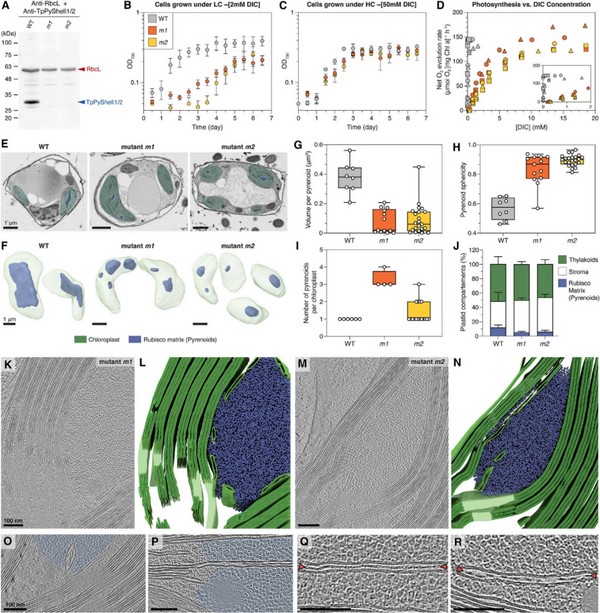
图5T.pseudonanaPyShell突变体的表型和光合参数
对细胞粗提取物进行蛋白免疫印迹,证明突变体中不存在TpPyShell1和2蛋白;B和C.野生型WT(灰色)、m1(橙色)和m2(黄色)在大气CO₂(LC;0.04%)和高浓度CO₂(HC:1%)中的生长状态;D.WT、m1和m2的光合活性对无机碳浓度的依赖性测定;E和F.WT、m1和m2细胞的FIB-SEM成像,叶绿体(绿色)、蛋白核Rubisco(蓝色);G-J.根据FIB-SEM数据对蛋白核进行形态定量分析;K-R.m1和m2细胞的Cryo-ET成像。
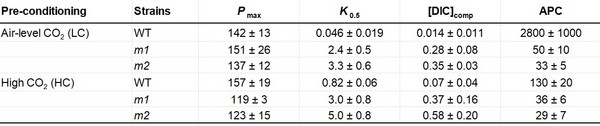
表1Pmax,最大净O2释放速率;K0.5,Pmax的一半时DIC浓度;[DIC]comp,无净O2释放时DIC浓度;APC,表观光合传导率。
进一步观察PyShell基因被破坏的硅藻二级叶绿体,发现正常的蛋白核结构无法形成,蛋白核周围的片状结构消失,蛋白核结构崩解并破碎。这表明由PyShell形成的正常蛋白核结构对Rubisco的CO₂供应至关重要(图6)。
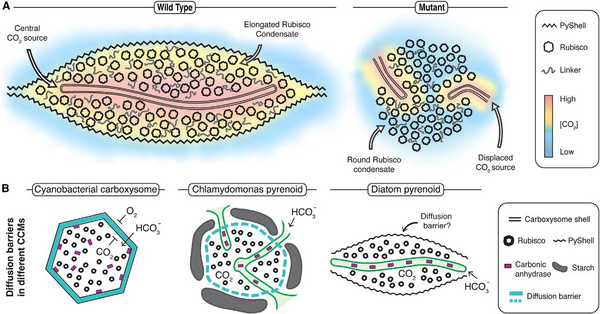
图6 PyShell在组织硅藻pyrenoid结构中的作用
综上所述,研究人员首次鉴定出包裹在硅藻pyrenoid周围的蛋白质外壳结构——PyShell,并从多个尺度上详细表征了PyShell晶格的精细构造。此外,研究人员通过对T.pseudonanaPyShell缺失突变体的深入功能分析,展示了PyShell在维持pyrenoid整体结构中的关键角色,使硅藻能够在CO₂浓度极低的环境中继续生长并高效固定碳,从而支撑其在全球海洋生态系统中的重要地位。这一系列发现不仅加深了我们对硅藻碳同化机制的认识,还为未来开发利用硅藻进行碳捕获与生物能源生产提供了新的可能。