使用M-PEA测定快速光曲线(RLCs)
一、概述
自20世纪90年代末以来,快速光曲线(RLCs)已被广泛应用于光合作用研究,其主要使用脉冲调制式荧光仪测定。本应用指南描述的是如何使用Hansatech公司的植物效率分析仪M-PEA(连续激发式荧光仪)测定RLCs。
二、光合作用研究中的光曲线
多年来,各种类型的光曲线一直被用于光合性能的研究,因为它们可以评估植物当前的光合能力以及在环境光强范围内的潜在活性(Ralph & Gademann, 2005)。
传统上的光合-光强响应曲线(或P-E曲线,图1)是通过测量不同环境光强下的放氧速率或碳固定速率获取的。

图1 光合-光强响应曲线
α斜率代表最大的光能利用效率,α斜率与光合作用最大值Pmax的交点代表最小饱和光强(Ik或Ek),反映植物对强光的耐受能力。
在超过最适光强后,光合速率下降(虚线部分),这种部分通常被称为光抑制或下调(Masojídek,2021)。稳态光曲线(SSLCs)是一种基于叶绿素荧光的测量协议绘制的电子传递速率(ETR)与光量子通量密度(PPFD)的函数曲线,并可与传统的P-E曲线相媲美(Houliez et al., 2017)。SSLCs从低光强至高光强依次测量光合速率。每一梯度的时间需要足够长,以便达到在这一梯度的稳态光合速率。完成SSLCs协议通常需要几分钟到几小时的时间。在野外条件下,当比较不同植物之间的结果时,这就带来了巨大的挑战,因为必须考虑到不同的因素,如测量时间、植物节律和天气变化等(Rascher et al., 2000)。
快速光曲线(RLCs)由一系列时间相对较短(<30s,通常为10s)的光强梯度组成,每一个梯度的光强依次增强(光强梯度由低到高)。各个梯度之间开饱和闪光测定ETR。与P-E光响应曲线或SSLCs不同,RLCs协议在各个光照梯度上不会达到稳态光合速率。P-E曲线显示的是与光反应无关的光合性能的最佳状态,RLCs显示的则是光合性能的当前状态。由于在RLCs中没有达到稳态条件,它们反映了在测量之前时期的光适应状态,也反映了较长期的光反应(Ralph & Gademann, 2005)。
除了总体光合性能外,RLCs还可提供与通过光系统II(PSII)的电子传输饱和特性相关的详细信息(Ralph and Gademann, 2005)。
用ETR与PPFD作图得RLCs,RLCs中显示三个不同的阶段(图2)。
1.光限制阶段在该阶段,光合速率受低光照水平的限制。参数α是ETR相对于PPFD上升的斜率,且其与光捕获效率(有效量子产率或φPSII)成正比(Schreiber, 2004)。2.光饱和阶段在该阶段,电子传递链的容量限制了电子传递速率。RLCs在ETR达到最大值时达到平台期(用参数ETRmax表示)(Schreiber, 2004)。最小饱和光强用参数Ek(或Ik)表示,由α与ETRmax的截距确定(Sakshaug,1997),其与淬灭相关。在Ek以下,光化学淬灭是主要途径,而在Ek以上,非光化学淬灭是主要途径(Henley, 1993)。3.光抑制/下调阶段
在这个区域,植物受到超饱和光强的照射,RLCs往往趋于下降趋势,这可能与光抑制有关(Henley, 1993)。这种下降效应更可能发生在传统的P-E曲线或SSLCs中,因为它们的光合速率达到了稳态。而RLCs中没有达到稳态,通常没有足够的时间发生光损伤。有人认为,在超饱和光强下ETR的下降可能与PSII的动态下调有关(White and Critchley, 1999)。
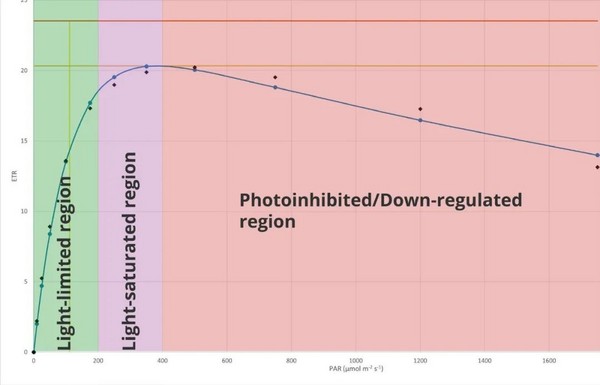
图2 RLCs的三个阶段A-光限制阶段;B-光饱和阶段;C-光抑制/下调阶段
三、快速光曲线的测定
RLCs协议通常以不超过10秒的初始准黑暗期开始。这允许初级电子受体(QA)的快速再氧化,而非光化学淬灭系数没有实质性的弛豫(Schreiber, 2004)。这与长时间的完全暗适应期形成对比,如在快速叶绿素荧光诱导曲线测量中使用的几分钟或更长时间的暗适应。在完全的暗适应下,光反应和暗反应变得不活跃,导致光系统的完全再氧化(Rascher et al., 2000)。如果PSI和PSII发生完全的再氧化,RLCs协议中的照明将产生诱导效应,使数据的解释更加复杂。准黑暗期之后紧接着是一个饱和闪光。随后是一个逐步增加的光化周期梯度,每个周期之后是一个饱和闪光。光化周期的典型持续时间为每个10秒。
光化光梯度的理想设置是在光限制、光饱和与光抑制三个区域中的每一个区域都生成几个数据点。对于弱光条件下光合作用更强的样品,在光限制区域测量更多的数据点有利于更好地估计α参数。如果样品耐强光,那么在光饱和与光抑制区域测量更多的数据点将提供更有趣的结果。

四、使用M-PEA测定RLCsM-PEA软件的协议编辑器,特别是其预照光功能,可用于测量与非调制式荧光仪相关的更典型参数和协议,如ΦPSII (Y(II)),ETR,NPQ和淬灭分析模型等。
您可以在Hansatech公司网站(Support>Applications)上下载提供的示例协议开始RLC测量。或者您可以安装和修改示例协议,也可以从头创建协议。网址为http://www.hansatech-instruments.com/hil-application-notes/。
关于命名法有一个重要的提示。因为M-PEA的控制和分析软件M PEA目前假定已经执行了一个暗适应协议,它将默认地对其分析工具中的测量参数应用暗适应命名法。
Hansatech公司网站上提供了一个Excel表格,用于执行解释RLCs数据所需的图形和统计分析。在将M-PEA数据导出到电子表格后,可以根据表1进行相应的参数命名调整转换。

表1 使用Handy PEA+测定的RLC参数默认命名的转换
使用示例协议
1.下载示例协议到您的电脑;
2. 将M-PEA连接到电脑;
3. 打开电脑上的M PEA软件;
4. 通过“M PEA>Protocol Editor”菜单选项,打开Protocol Editor协议编辑器;
5. 在Protocol Editor协议编辑器中,选择“File>Open”;
6. 导航至电脑上的示例协议,点击“Open”;
7. 在Protocol Editor协议编辑器的左侧,点击“Light Table”按钮;
8. 进入“Light Table”窗口,在“Pre-Acquisition”区域的“Illumination”定义RLCs的光化光梯度光强。

图3 Protocol Editor协议编辑器中的Light Table窗口
10. 在Protocol Editor协议编辑器的左侧,点击“Upload”按钮;
11. 当上传完成后,该软件将生成一个通知;
12. 按照下面“Running the RLC Protocol”部分的说明操作。
从头创建RLC协议
请按照以下步骤在M PEA软件中创建RLC协议。
1. 在M PEA软件中,打开协议编辑器;
2. 点击“Options”按钮并定义协议的名称;
3. 在“Records”后输入10,这将产生10个单独的光梯度;
4. 此屏幕中的所有其他设置可能未选中(Channel 2,Far red,DF,Repeats)
5. 点击“Light Table””按钮,以查看单独的灯光步骤设置
6. 将“Pre Acquisition”中的“Duration”设置为<30s(推荐10s);
7. 将Number1对应的illumination数值设置为0,来实现准黑暗期;
8. 在随后的illumination框中,设置一组光化光梯度光强,以覆盖光限制、光饱和。光抑制三个区域;
9. 在“Recording”区域,将“Duration”设置为1s;
10. 在“Recording”区域,将所有illumination数值设置为>3500umol/m2/s;
11. 将协议上传至M-PEA。
运行RLC协议
1. 在所测样品上放置M-PEA暗适应叶夹,不要关闭遮光片,因为光系统的完全再氧化会导致RLC产生诱导效应,使数据更加复杂(Rascher et al., 2000);
2. 将M-PEA探头安装到叶夹上,并尽快开始测量,以避免样品长时间的暗适应,测量过程中要确保样品稳定地保持在叶夹内的位置上;
3. 一旦完成,数据将自动传输到M-PEA。
分析RLC数据
如上所述,M-PEA软件默认测量数据已经执行了暗适应,并在此基础上应用命名法。在RLC协议期间测量的数据来自光适应后的样品,因此,对于协议期间进行的每一次测量,M-PEA软件中显示的参数应当重新标记,如表1。M-PEA软件目前不提供解释RLC数据所需的图形和统计分析。但,Hansatech公司网站上提供一个Excel表格,M-PEA测量的RLC数据可复制粘贴至其中,进行处理。RLC模板采用Platt等人(1980)的方程将M-PEA测量的原始数据建模曲线。该模板要求在Excel中启用解算器插件。解算器插件使用GRG非线性方法最小化误差平方和(SSE),用于计算最佳解/拟合。该模板包括一些示例RLC分析工作表,以供参考(图4)。
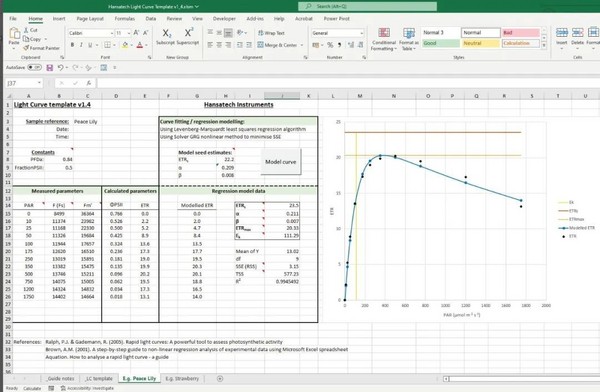
图4 RLC数据处理模板
该模板可从Hansatech网站的“Support>Applications”页面下载。具体操作步骤如下。
1. 确保M-PEA软件的Summary选项卡内显示来自RLC协议的所有测量记录;
2. 打开Parameters选项卡,确保显示参数Fo和Fm。如果未显示,可通过“Tools>’Parameter View’Parameters”启用;
3. 将空白RLC模板复制到新的工作表中;
4. 在“Measured parameters”下的F(Fs)这一列内输入对应的Fo;
5. 在“Measured parameters”下的Fm’这一列内输入对应的Fm;
6. 在“Measured parameters”下的PAR这一列输入M-PEA软件的Protocol选项卡内对应的Pre Acquisition “illum(uM)”;
7. φPSII和ETR的值是自动计算的,ETR是使用单元格B8和B9中定义的常数来计算的,PFDa和FractionPSII分别设置为0.84和0.5,如果有需要,可更改;
8. 依次将“Measured parameters”下的PAR、F(Fs)和Fm’对应的Pre Acquisition “illum(uM)”、Fo和Fm输入,φPSII和ETR将自动计算完毕;
9. 点击“Plot curve”按钮运行解算器,这将最小化误差平方和(SSE),并生成一条曲线,ETRs、α、β、ETRmax和Ek的最佳拟合值也被计算出。
参考文献:
[1]BAKER NR. (2008). Chlorophyll fluorescence: a probe of photosynthesis in vivo. Annual Review of Plant Biology 59, 89–113.
[[2] HENLEY WJ (1993). Measurement and interpretation of photosynthetic light-response curves in algae in the context of photoinhibition and diel changes. J Phycol 29:729–738
[3]HOULIEZ, E., LEFEBVRE, S., LIZON, F., SCHMITT, F.G., (2017). Rapid light curves (RLC) or non‑sequential steady‑state light curves (N‑SSLC): which fluorescence‑based light response curve methodology robustly characterizes phytoplankton photosynthetic activity and acclimation status? Mar Biol (2017) 164:175
[4] MASOJÍDEK, J.; RANGLOVÁ, K.; LAKATOS, G.E.; SILVA BENAVIDES, A.M.; TORZILLO, G. (2021). Variables Governing Photosynthesis and Growth in Microalgae Mass Cultures. Processes, 9, 820.
[5] PLATT, T., GALLEGOS, C.L., HARRISON, W.G. (1980). Photoinhibition of photosynthesis in natural assemblages of marine phytoplankton. J. Mar. Res., 38: 687-401
[6] RALPH, P.J. & GADEMANN, R. (2005). Rapid light curves: a powerful tool to assess photosynthetic capacity. Aquat. Bot., 82: 222–237.
[7] RASCHER, U., LIEBIG, M., LÜTTGE, U., (2000). Evaluation of instant light-response curves of chlorophyll fluorescence parameters obtained with a portable chlorophyll fluorometer on site in the field. Plant Cell Environ. 23, 1397–1405.
[8]SAKSHAUG, E., BRICAUD, A., DANDONNEAU, Y., FALKOWSKI, P.G., KIEFER, D.A., LEGENDRE, L., MOREL, A., PARSLOW, J., TAKAHSHI, M., (1997) Parameters of photosynthesis: definitions, theory and interpretation of results. J Plankton Res 19:1637–1670
[9] SCHREIBER U (2004). Pulse-amplitude-modulation (PAM) fluorometry and saturation pulse method: an overview. In: Papageorgiou G, Govindjee (eds) Chlorophyll fluorescence: a signature of photosynthesis, vol 19. Kluwer Academic Publishers, Dordrecht, pp 279–319
[10] WHITE, A.J., & CRITCHLEY, C. (1999). Rapid light curves: a new fluorescence method to assess the state of the photosynthetic apparatus. Photosynth. Res., 59, 63–72.












![聚酰胺粉 [柱层析用,高分离性能] 60-100目/80-120目/100-200目](https://p-06.caigou.com.cn/135x120/2024/7/2024071513085253637.jpg)