CRISPR-Cas9作为一种有效的基因编辑方法,在疾病预防与治疗中具有巨大的潜能,但是在临床转化中必须要考虑到它的脱靶效应。传统的生物学手段如电泳或测序等,虽然也可以用来研究Cas9的靶向性,但是其结果大多数为静态的、平均的。2019年3月发表在Nature Structural and Molecular Biology期刊上的新文章 ,采用新的荧光光镊技术,利用光镊操纵DNA模板,结合共聚焦荧光显微成像系统,实现了在单分子水平动态的观察Cas9对目的基因的靶向编辑。
结果表明,当DNA松弛时,CRISPR的编辑具有特异性,但是当DNA被拉伸时,CRISPR编辑准确性降低,并出现脱靶编辑,其脱靶的概率随着受力的增加而增加。这项研究将有助于设计具有更高准确度的CRISPR系统。
Hold the molecule & Look at it!
深入了解单分子的相互作用有助于科学家更好地回答基本的生命科学问题。如何在单分子水平开展生物分子的动态研究也是单分子生物物理领域的一个难题。原子力显微镜、光镊等单分子操纵技术的出现使得这种研究成为了可能。荷兰LUMICKS公司研发的C-Trap荧光光镊系统采用双光镊 荧光共聚焦成像技术,是研究单分子互作的有力工具!
LUMICKS荧光光镊系统新表面成像解决方案:Surface Assay Toolkit
除了和共聚焦显微成像系统联用,LUMICKS新推出了IRM、WD&TIRF成像系统的解决方案,将单分子的研究拓展到了细胞学水平!
利用IRM(interference reflection microscopy)技术无需标记即可实时观察微管微丝的形态,背景噪声低,适用于细胞骨架的动态捕获。结合IRM和TIRF可以实时观测微丝、马达蛋白以及其他蛋白的动态变化。
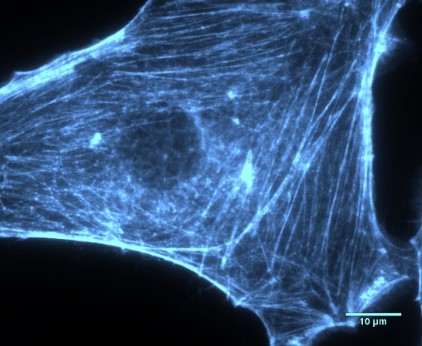
结合表面的荧光成像手段(宽场照明Widefield和全内反射照明TIRF),可以对生物样品进行快速成像,适用于细胞与分子相互作用等研究。
C-Trap荧光光镊系统新发表文献:
荧光光镊系统的出现使得科学家可以更加简单地进行一系列单分子的研究,如DNA复制、转录、翻译过程中与蛋白的相互作用;蛋白等小分子的构象变化;细胞骨架与细胞内物质转运;小分子与蛋白互作等。
Salt-Dependent Rheology and Surface Tension of Protein Condensates Using Optical Traps Physical Review Letters, 2018
Molecular Crowding Tunes Material States of Ribonucleoprotein Condensates Biomolecules, 2019
Sites of high local frustration in DNA origami Nature Communication, 2019
DNA stretching induces Cas9 off-target activity Nature Structural Molecular Biology, 2019













![聚酰胺粉 [柱层析用,高分离性能] 60-100目/80-120目/100-200目](https://p-06.caigou.com.cn/135x120/2024/7/2024071513085253637.jpg)