植物面对各种生物和非生物胁迫时,会调整它们的响应机制来优化发育和适应程序。UV辐射作为一种环境因子,会影响植物的光合过程并触发细胞死亡。华沙生命科学大学的AnnaRusaczonek评估了红/远红光感受器光敏色素A和光敏色素B在拟南芥UV胁迫响应中的作用。通过测量相关突变株的CO2同化、叶绿素荧光(包括荧光淬灭动力学曲线和OJIP快速荧光动力学曲线)、活性氧积累等,他发现UV胁迫干扰了光系统II,并增加了相关突变体的死亡率。


图1. UV处理的拟南芥野生型及突变株
CO2同化速率反映了光合作用整个过程的最终结果,而叶绿素荧光则直接反映光合作用光反应部分的光系统电子传递过程变化。因此最理想的情况是能够同步测量这两类数据。本研究中就使用了光合仪和光合联用型FluorCam叶绿素荧光成像仪,同步测量了光合作用光响应曲线和CO2相应曲线。
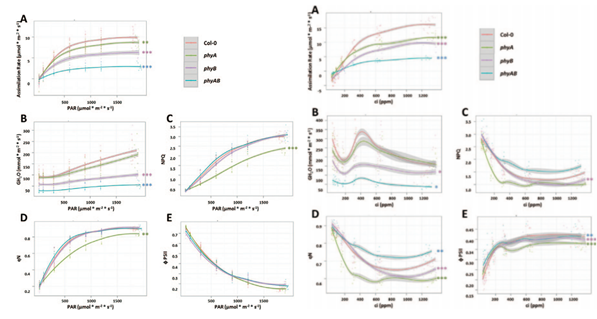


图2. 左:光响应曲线;右:CO2相应曲线
为了进一步验证光系统II受损的机理过程,除了叶绿素荧光淬灭参数以外,本研究还使用封闭式FluorCam叶绿素荧光成像系统测量了OJIP快速荧光动力学曲线。封闭式FluorCam叶绿素荧光成像系统是目前国际上唯一可以进行叶片OJIP成像测量的商用仪器。在不需要成像图的情况下,也可以使用FluorPen叶绿素荧光仪测量OJIP曲线及相应参数。
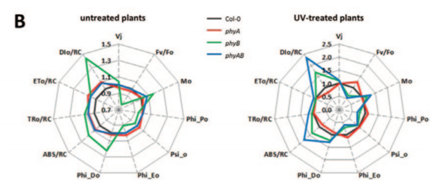

图3. OJIP快速荧光动力学参数
在测量SOD过氧化物歧化酶时,需要对样品进行暗处理和光处理进行对照实验。SL3500智能LED光源以其高光强、高纯度、精确调控,成为了这一实验的不二之选。如果使用培养配备SL3500光源的FytoScope植物生长箱同步调控光照和温度,数据精度还能进一步提高。


图4. 不同型号、光质的SL3500 智能LED光源
同时为了确定在微观尺度,单个叶绿体的变化,还需要进行显微叶绿素荧光测量。很遗憾的是,因为作者的条件所限,只能使用普通的荧光显微镜。而普通的荧光显微镜因为不具备脉冲调制功能,因此只能测量一个实时的平均荧光强度,根本无法进行真正的叶绿素荧光淬灭测量。FKM(Fluorescence Kinetic Microscope)多光谱荧光动态显微成像系统是目前国际上唯一可进行亚细胞级PAM脉冲调制叶绿素荧光测量的仪器,是研究植物/藻类细胞、叶绿体微观光合能力必不可少的。无论是成像质量还是测量真正有意义的光合表型参数,FKM系统都要远远优于普通荧光显微镜。


图5. 本研究中使用普通荧光显微镜获得的叶绿素荧光成像图及平均荧光强度


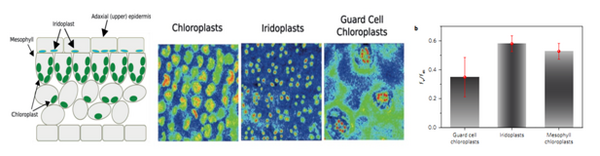

图6. Nature Plants发表文章:使用FKM系统测量秋海棠特异叶绿体荧光成像图及Fv/Fm最大光化学效率(Jacobs,2016)
模块式植物表型分析技术方案推荐:
1. 基础方案:LCi T便携式光合仪 光合联用型FluorCam叶绿素荧光成像仪 FP110手持式叶绿素荧光仪 SL3500 智能LED光源
2. 进阶方案:LCPro T 全自动便携式光合仪 光合联用型FluorCam叶绿素荧光成像仪 封闭式FluorCam叶绿素荧光成像系统(配备OJIP成像功能) FytoScope植物生长箱
3. 高级方案:LCPro T 全自动便携式光合仪 光合联用型FluorCam叶绿素荧光成像仪 封闭式FluorCam叶绿素荧光成像系统(配备OJIP成像功能) FytoScope植物生长箱 FKM多光谱荧光动态显微成像系统





参考文献:
1. Rusaczonek A, et al. 2015. Role of phytochromes A and B in the regulation of cell death and acclimatory responses to UV stress in Arabidopsis thaliana. Journal of Experimental Botany DOI: 10.1093/jxb/erv375
2. Jacobs M, et al. 2016.Photonic multilayer structure of Begonia chloroplasts enhances photosynthetic efficiency. Nature Plants, doi:10.1038/nplants.2016.162




















![聚酰胺粉 [柱层析用,高分离性能] 60-100目/80-120目/100-200目](https://p-06.caigou.com.cn/135x120/2024/7/2024071513085253637.jpg)