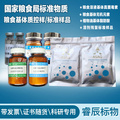
酵母基因组DNA提取试剂盒
Yeast DNA Kit
●试剂盒内容及保存:
试剂盒组成 | RTG2409 (50次) | 贮存方式 |
缓冲液YL | 13 ml | 常温 |
缓冲液YBL | 13 ml | 常温 |
缓冲液SE | 15 ml | 常温 |
DNA Wash Buffer(浓缩液) | 13 ml | 常温 |
缓冲液WB | 30 ml | 常温 |
洗脱缓冲液EB | 15 ml | 常温 |
蛋白酶K | 1 ml | -20℃ |
Lyticase | 1.6 ml | -20℃ |
RNaseA | 0.5 ml | -20℃ |
Glass Beads | 3 g | 常温 |
吸附柱CG | 50个 | 常温 |
收集管(2 ml) | 50个 | 常温 |
说明书 | 1份 |
|
●储存条件和效期:
室温保存,12个月内有效。Proteinase K与Lyticase-20℃保存。缓冲液 YBL与缓冲液 YL可能有沉淀产生,37度水浴溶解后即可。
●产品简介:
酵母DNA提取试剂盒(Yeast DNA Kit)采用了一种新型的硅胶柱。在特定条件下,使DNA能在离心过柱的瞬间,结合到纯化柱上,在一定条件下又能将DNA充分洗脱,从而实现DNA的快速纯化。无需酚氯仿抽提,无需酒精沉淀。纯化的DNA可直接用于PCR、Southern杂交和酶切等。
●准备工作:
1. 准备30℃,65℃,70℃水浴;无水乙醇;制冰机;1.5ml离心管;2ml离心管
2. 按照标签所示在DNA Wash Buffer中加入无水乙醇,混匀后盖紧瓶盖后室温贮存备用。
3. 每次使用前请检查缓冲液YBL,缓冲液YL是否有沉淀生成,如果出现沉淀,37℃温浴至沉淀溶解后再使用。
●标准操作步骤:
如非指出,所有离心步骤均为使用台式离心机在室温下离心。
1. 取1-3 ml 酵母培养物(不超过3×107酵母细胞),12,000 rpm (~13,400×g )离心1分钟,尽量吸除上清(菌液较多时可以通过几次离心将菌体沉淀收集到一个离心管中)。
注:可用分光光度计或平板培养法检测菌体量,一般对于酿酒酵母OD600值为1.0时,相当于1-2×107cell/ml。
2. 加入480 μl 缓冲液 SE,完全重悬细胞。加入30μl Lyticase溶液。30℃水浴处理30min。期间振荡几次。
注意:以处理时间为经验值,根据酵母菌株和酵母细胞数量的不同,孵育时间应该进行适当调整。
3. 4000 rpm(~1500×g)离心10钟,弃上清,收集沉淀。加入200μl 缓冲液 YL重悬。加入50mg Glass Beads,剧烈涡旋5min。
4. 加入20μl 蛋白酶K,混匀。65℃水浴孵育直至裂解完全,孵育过程中,涡旋几次。一般来说1小时以内能彻底裂解。
5. 可选步骤:加入5μl RNaseA并反复颠倒混匀,在室温条件下孵育5分钟。
6. 12,000 rpm (~13,400×g )离心1分钟,转移上清至新的离心管中。
7. 加入220 μl 缓冲液YBL,振荡15 秒,70℃放置10 分钟,溶液应变清亮。
注意:加缓冲液YBL 时可能会产生白色沉淀,一般70℃放置时会消失,不会影响后续实验。如溶液未变清亮,说明细胞裂解不彻底,可能导致提取DNA量少和提取出的DNA不纯。
8. 加220 μl 无水乙醇,充分混匀,此时可能会出现絮状沉淀。
9. 将上一步所得溶液和絮状沉淀都加入吸附柱中(吸附柱放入收集管中),12,000 rpm (~13,400×g ) 离心30 秒,倒掉废液,将吸附柱放入收集管中。
10. 向吸附柱中加入500 μl 缓冲液 WB,12,000 rpm (~13,400×g ) 离心30 秒,倒掉废液,将吸附柱放入收集管中。
11. 向吸附柱 中加入600 μl DNA Wash Buffer(使用前请先检查是否已加入无水乙醇),12,000 rpm (~13,400×g ) 离心30秒,倒掉废液,吸附柱放入收集管中。
12. 向吸附柱中加入600 μl DNA Wash Buffer,12,000 rpm (~13,400×g ) 离心30秒,倒掉废液,将吸附柱放入收集管中。
13. 12,000 rpm(~13,400×g)离心2 分钟,以彻底晾干吸附材料中残余的漂洗液。
14. 将吸附柱转入一个干净的离心管中,向吸附膜的中间部位悬空滴加50-200 μl 洗脱缓冲液EB或灭菌去离子水,室温放置2-5分钟,12,000 rpm (~13,400×g ) 离心1分钟,将溶液收集到离心管中。
注:洗脱缓冲液体积不应少于50 μl,体积过小影响回收效率。洗脱液的pH值对于洗脱效率有很大影响。若用水做洗脱液应保证其pH 值在7.0-8.5 范围内(可以用NaOH将水的pH 值调到此范围),pH 值低于7.0 会降低洗脱效率;
15. DNA产物应保存在-20℃,以防DNA降解。
●DNA浓度及纯度检测:
基因组DNA片段的大小与样品保存时间、操作过程中的剪切力等因素有关。提取的DNA片段可用琼脂糖凝胶电泳和紫外分光光度计检测浓度与纯度。可配制0.8-1.0%琼脂糖凝胶,使用λ/HindIII判断基因组的大小,完整的基因组大小应在23kb以上。使用分光光度计检测时,OD260/OD280比值应为1.7–1.9之间,如果洗脱时不使用洗脱缓冲液,而使用去离子水洗脱,比值可能偏低,但并不表明DNA纯度不高。
●常见问题分析:
常见问题 | 可能原因 | 建议 |
堵柱子 | 样品量太多,裂解不完全,样品太粘稠 | 降低样品量; 延长Lyticase酶解时间; 延长加入缓冲液YBL和蛋白酶后的裂解放置时间 |
低浓度的DNA量 | 柱子堵塞 | 见上 |
DNA残留在柱子上 | 增加洗脱液的用量,并在离心洗脱前将洗脱液EB65℃孵育5min。 | |
DNA洗涤不当 | DNA Wash Buffer按说明书用无水乙醇稀释。 | |
下游应用不好 | 提取的DNA含盐量高 | DNA Wash Buffer如果必须按要求用无水乙醇稀释,必须室温放置。 |
提取的DNA含有乙醇 | 洗脱前,必须最高转速空甩柱子1min。 |












![聚酰胺粉 [柱层析用,高分离性能] 60-100目/80-120目/100-200目](https://p-06.caigou.com.cn/135x120/2024/7/2024071513085253637.jpg)