AtomTraceLIBS元素分析技术
——应用于植物金属元素分布快速Mapping
AtomTrace是欧洲工程技术中心(CEITEC)的唯一衍生公司,公司成员均为布尔诺大学激光光谱与化学分析实验室的科研人员。实验室起始于1997年,在LIBS应用技术研发领域具有近20年的深厚经验,其研制生产的Sci-Trace LIBS元素分析系统获得捷克国家2016年年度最佳合作奖冠军。而在此之前,AtomTrace团队曾在欧洲LIBS元素分析大赛中斩获第一名的优异成绩!
使用Sci-Trace,便意味着得到了全球顶尖的专业团队技术支持和实验室合作。


不同的营养及矿物质含量,极大的影响植物的生长和代谢对于环境的响应。元素测量一直采用ICP-OES或者AAS的传统方法,缺点是样品预处理复杂,容易引入新的杂质并造成测量误差。但最关键的是,无法得到元素分布的空间信息。而如若分布模式不同,即使含量相近,对植物生理状态的影响也差异巨大。而LIBS技术可以在植物活体状态下无须预处理进行元素mapping扫描快速分析,恰恰弥补了这一缺憾。LA-ICP-MS技术同也可进行元素分布扫描,但仍存很多问题有待克服:激光烧蚀样品经载气运送至ICP,会在运送管中有颗粒物残留; ICP中大颗粒气化不完全;记忆效应(前次测量对下次测量结果的影响);雾化室及运送管中的死角对信号强度和持续时间的影响;必须在同一位置多次测量才能获得足够强的信号等等。因此对于植物中元素分布的测量,LIBS被认为是最优也是最有前景的测量技术。
AtomTrace研究团队很早就关注到LIBS技术在植物科学领域的应用。2006年,JozefKaiser博士(AtomTraceCEO、布尔诺科技大学光谱技术实验室主任)等即在EuropeanPhysicalJournal上发表了“Femtosecond laser spectrochemical analysis of plant samples”,应用libs技术对山茱萸整个叶片中的Fe、Mn元素进行分布mapping研究。当时在该实验中,Fe的LOD(检测限)已经做到5ppm。
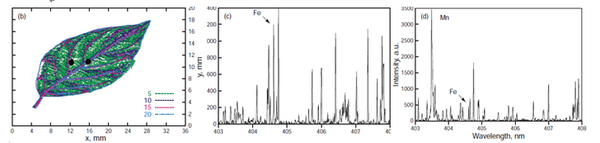
AtomTrace团队应用LIBS技术在植物元素分析领域一直在孜孜不倦的探索,优化算法、开发软件、优化仪器-----例如用真空反应室、双激发技术等提高mapping分辨率,开发AtomAnalyzer光谱数据分析软件将计算速度提高10倍,研制紫外真空模块检测0-300nm紫外光区域谱线等。测试对象既有活体植物,也有干枯样品;包括植物根、茎、叶等植物各部分组织;植物种类包括旱生植物,也包括高水分含量的水生植物;定性定量测量的元素涉及对植物有重要影响的Al、Ca、C、Mg、P、Si、Sr、Zn、B、Cu、Fe、Mn、Pb、K、S、Na、Cl、H、N、Ni、Ba、Ag等等。并发表植物LIBS分析领域高影响因子文章如下:
1. Pavlína M, Karel N, Pavel P, Jakub K, Přemysl L, Helena Z. G, Kaiser J, Comparative investigation of toxicity and bioaccumulation of Cd-based quantum dots and Cd salt in freshwater plant Lemna minor L.[J],Ecotoxicology and Environmental Safety, 147 (2018) 334–341.
2. Krajcarová L, Novotný K, Kummerová M, J. Dubová J, Gloser V, Kaiser J. Mapping of the spatial distribution of silver nanoparticles in root tissues of Viciafaba bylaser-inducedbreakdownspectroscopy(LIBS) [J], Talanta173 (2017) 28–35.
3. Lucie K, Novotny K, Petr B, Ivo P, Petra K, Vojtech A, Madhavi Z. Rene K, Kaiser J, Copper Transport and Accumulation in Spruce Stems Revealed by Laser-Induced Breakdown Spectroscopy, [J]. Electrochemical Science, 8 (2013) 4485 – 4504.
4. Zitka O, Krystofova O, Hynek D, et al. Metal Transporters in Plants [M]. Heavy Metal Stress in Plants. 2013: 19-41.
5. Kaiser J, Novotny K, Martin M Z, et al. Trace elemental analysis by laser-induced breakdown spectroscopy—Biological applications [J]. Surface Science Reports, 2012, 67 (11–12): 233-243.
6. Michaela G, Jozef K, Karel N, et al. Utilization of laser-assisted analytical methods for monitoring of lead and nutrition elements distribution in fresh and dried Capsicum annuum I. leaves [J]. Microscopy Research and Technique, 2011, 74 (9): 845-852.
7. Diopan V, Shestivska V, Zitka O, et al. Determination of Plant Thiols by Liquid Chromatography Coupled with Coulometric and Amperometric Detection in Lettuce Treated by Lead (II) Ions [J]. Electroanalysis, 2010, 22 (11): 1248-1259.
8. Kaiser J, Galiova M, Novotny K, et al. Utilization of the Laser Induced Plasma Spectroscopy for monitoring of the metal accumulation in plant tissues with high spatial resolution [J]. Networking IEEE/ACM Transactions on, 2010, 20 (4): 1096-1111.
9. Kaiser J, Galiova M, Novotny K, et al. Mapping of lead, magnesium and copper accumulation in plant tissues by laser-induced breakdown spectroscopy and laser-ablation inductively coupled plasma mass spectrometry [J]. Spectrochimica Acta Part B Atomic Spectroscopy, 2009, 64 (1): 67-73.
10. Krystofova O, Shestivska V, Galiova M, et al. Sunflower Plants as Bioindicators of Environmental Pollution with Lead (II) Ions [J]. Sensors, 2009, 9 (7): 5040-5058.
11. Kaiser J, Galiova M, Novotny K, et al. Mapping of the heavy-metal pollutants in plant tissues by Laser-Induced Breakdown Spectroscopy [C]Spectrochimica Acta Part B 64 (2009) 67–73.
12. Galiova M, Kaiser J, Novotny K, et al. Investigation of heavy-metal accumulation in selected plant samples using laser induced breakdown spectroscopy and laser ablation inductively coupled plasma mass spectrometry [J]. Applied Physics A, 2008, 93 (4): 917-922.
13. Sona K, Pavel R, Olga K, et al. Multi-instrumental analysis of tissues of sunflower plants treated with silver(I) ions – plants as bioindicators of environmental pollution [J]. Sensors, 2008, 8 (1): 445-463.
14. Stejskal K, Mendelova Z, et al., Study of effects of lead ions on sugar beet [J]. ListyCukrovarnicke A Reparske, 2008, 124 (4): 116-119.
15. Galiova M, Kaiser J, Novotny K, et al. Utilization of laser induced breakdown spectroscopy for investigation of the metal accumulation in vegetal tissues [J]. Spectrochimica Acta Part B Atomic Spectroscopy, 2007, 62 (12): 1597-1605.
16. Kaiser J, Samek O, Reale L, et al. Monitoring of the heavy-metal hyperaccumulation in vegetal tissues by X-ray radiography and by femto-second laser induced breakdown spectroscopy [J]. Microscopy Research and Technique, 2007, 70 (70): 147-153.
AtomTrace团队应用LIBS技术进行植物中金属元素分布的研究案例

浮萍(Lemna minor L.)是金属元素环境污染的指示物种,也是常被用于金属毒害和富集作用研究的模式生物。本案例中,AtomTrace团队应用LIBS技术对浮萍做元素分布mapping,比较研究Cd盐和QDs中的Cd元素在浮萍中的富集模式;并应用传统ICP-OES技术对不同含Cd化合物在浮萍中的含量和富集进行测量;同时应用TEM方法探究QDs的富集位置---浮萍表面、细胞内部、还是植物组织内。
注:Cd离子在2015年275种重要有害物质清单中排名第7。含Cd量子点(QDs)通常由直径3-6 nm的CdS、CdSe、PbSe及CdTe和其它一些金属元素构成,其外覆有有机聚合物。由于其染料效果优于其它生物染料所以大量排放至水域中并在水中释放出Cd离子,所以研究Cd量子点对生物的毒害作用有重要的应用意义。
使用双激发LIBS技术研究Cd元素在浮萍小叶中的分布情况
实验方法:
浮萍叶片分别在含镉化合物CdCl2、MPA-QDs 及 GSH-QDs 溶液(该三种溶液浓度皆分别设为三个梯度:0.1、 1和 10 mg/L)中处理。将小叶贴于载玻片上制作样品;
LIBS测量采用正交双激发。一次激发激光波长266nm,脉冲能量10mJ;二次激发激光波长1064nm,脉冲能量1064mJ;两次激发激光脉冲长度均为5nm。每次测量均将叶片击穿。
扫描测量分辨率:200μm;
Cd检测主谱线:508.58 nm;

Fig. 4 Cd量子点及Cd盐处理下浮萍小叶元素mapping图像
实验结论:
CdCl2和Cd-QDs污染,对于Cd元素在浮萍叶片表面分布的影响无区别;
浓度不同,对于Cd元素在浮萍叶片表面分布的影响无区别;
实验中三种含镉化合物(CdCl2、MPA-QDs、GSH-QDs)浓度升高,LIBS检测信号皆随之增强;
茎结处Cd元素富集作用明显高于其它组织

引自:Pavlína, M., Karel, N., Pavel, P., J, K., P, L., H, Z.G., Jozef, K., 2018. Comparative investigation of toxicity and bioaccumulation of Cd-based quantum dots and Cd salt in freshwater plant Lemna minor L.[J]. Ecotoxicology and Environmental Safety 147 (2018) 334–341
对植物组织的元素进行LIBS mapping分析,可以通过谱线位置判别元素种类,通过谱线强度得到元素浓度,而元素mapping图像可以得到元素分布、以及若干种元素的相关位置分布信息。而在同一位置连续测量,即可得到元素剖面分布的3D信息。
Fig. 5 所示实验研究:
Fig. 5 A:莴苣叶片上,Pb元素对Mg元素分布的影响。Mg是叶绿素的关键金属,而Pb元素对叶绿素却有更强的亲和性,因此叶片中Pb浓度上升时,Mg浓度下降。
Fig. 5 B:Pb处理使玉米叶片中Pb浓度增加。
Fig. 5 C:植物对金属离子毒害的抗性各不相同。如图中所示向日葵叶片中,Pb处理对Mg元素的分布无影响。该实验结果与形态学分析实验结果一致。
Fig. 5 D:LIBS技术也可应用于植物其它组织中的元素分析。如图中所示松树枝条的双激发LIBS测量所得的3D元素分布图。

Fig. 5
引自:Jozef, K., Karel, N., et al., Trace elemental analysis by laser-induced breakdown spectroscopy—Biologicalapplications. Surface Science Reports 67 (2012) 233–243

根部对于植物养分供应、保护植物避免受到过量金属离子的毒害方面发挥着重要作用,但是根部元素分析的难度要远远大于对茎部组织,原因包括:根通常要比茎和芽细小很多;干物质含量小很多,为样品切割带来很大不便;通常待分析元素相对含量较低;而柔软多汁的样品如何保持其结构形状以得到元素分布的正确结果,同样是个难题。
AtomTrace针对上述挑战,在本案例中进行了成功的探索---应用双激发LIBS技术对蚕豆幼苗根部纳米银颗粒(直径为21.7±2.3 nm)进行mapping分析,目标是对自然状态下的植物组织进行元素检测,获得高mapping分辨率的同时确保检测灵敏度。这同时也是整个LIBS领域中,对植物根部纳米颗粒分布情况的初次尝试。
LIBS双激发技术 ---即每次采集的测量信号,都为两次激光脉冲激发。如此可减轻烧蚀扰动并提高mapping分辨率;同时两次激发可增强信号,以获得可重复性更高、更优LOD(检测限)的检测结果。
实验参数:二次激发脉冲能量分别为5MJ@266nm和100MJ@1064nm,间隔为500ns;测量频率为1次/秒;实验在1个大气压下进行。
实验材料:蚕豆幼苗,分辨在AgNP溶液、Cu 和Ag 离子溶液处理7天,做40μm厚切片进行LIBSmapping测量。
实验结果:由以下实验结果可见,LIBS技术检测速度快;即使对直径只有2mm的幼根,也可对其横切面中的金属离子及金属纳米颗粒分布进行mapping分析,检测的精确度和图像分辨率足以满足实验需求。应用双激发技术,Mapping分辨率可达到50μm,足以区分根表皮层、皮层、中柱中的元素分布特征。
此外,7天的短时间处理即可检测结果,说明对自然环境中、自然养分条件下的植物来说,LIBS元素mapping也是元素分布检测行之有效的实验方法,因此将是植物生理学和环境毒理学领域中的有效应用。

Fig.6蚕豆幼苗根横切进行分辨率为50μm的单线测量后,烧蚀坑情况
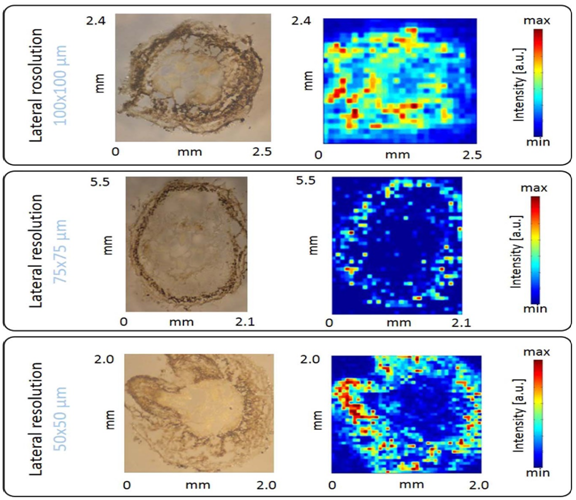
Fig.7 Cu 溶液处理蚕豆幼苗根横切不同分辨率下mapping结果:100μm、75μm、50μm
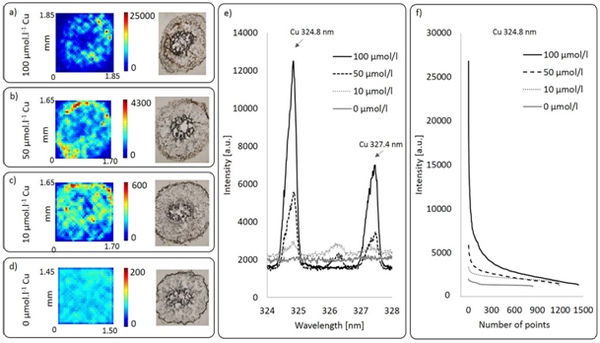
Fig.8 不同浓度Cu2 溶液【a) 100 μmol l−1 Cu2 ;b)50 μmol l−1 Cu2 ;c) 10μmol l−1 Cu2 ; d) 0 μmol l−1 Cu2 】处理蚕豆幼苗根横切mapping结果;e)样品区特征谱线;f)Cu2 浓度降低,其对应谱线强度也依次降低
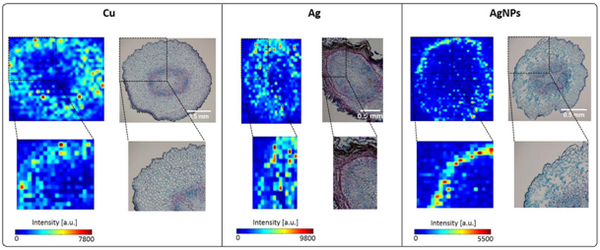
Fig.8 Cu2 、Ag 、AgNPs处理7日后的蚕豆幼苗根部横切的显微图像和元素mapping对应结果(引自:Krajcarová L, Novotný K, Kummerová M, J. Dubová J, Gloser V, Kaiser J. Mapping of the spatial distribution of silver nanoparticles in root tissues of Viciafaba bylaser-inducedbreakdownspectroscopy(LIBS) [J], Talanta 173 (2017) 28–35.)

北京易科泰生态技术有限公司是由科学家创建并为科学家提供顶尖科技服务的高新技术企业,是AtomTrace公司在中国(包括香港、台湾地区)的独家代理和技术咨询服务中心。易科泰生态技术公司在青岛、西安设有分公司,在全国各地设有办事处,北京总部设立有EcoLab实验室以提供实验研究合作、仪器技术培训等。
















![聚酰胺粉 [柱层析用,高分离性能] 60-100目/80-120目/100-200目](https://p-06.caigou.com.cn/135x120/2024/7/2024071513085253637.jpg)