沃特世公司(Waters®)近日开展了一系列活动为中国制药行业全面解读国家食品药品监督管理局(CFDA)发布的《药品生产质量管理规范(2010年修订)》(GMP法规)计算机化系统附录(以下简称“《计算机化系统》”),帮助制药企业应对全新附录所带来的严峻挑战。
GMP法规新附录《计算机化系统》将于2015年12月1日起执行,新附录对制药企业计算机化系统的验证、数据合规性、数据安全性、数据备份等提出了明确要求。在开放化的市场竞争和国际化法规监管的双重压力下,如何在提高质量的前提下兼顾效率是国内制药面临的共同挑战。
目前制药企业中,有些规模较小的实验室还采用单机版色谱工作站来处理色谱数据。根据新的《计算机化系统》附录明确要求,每套计算机化系统必须进行验证,对于规模化的实验室来说,如果每一台仪器都作为独立系统逐一进行验证,则费用会大幅增加。而当实验室仪器数量达到5台以上,就需要考虑比较单机版与网络版软件的平均成本。相较之下,网络版软件只在首次部署的时候产生验证成本,无疑将成为制药企业在满足验证要求的同时降低成本的有效途径。使用网络版软件,未来再接入新仪器时,都只需对仪器硬件进行确认即可,无需再对软件进行全面的重新验证。如此,单机版与网络版软件的平均验证成本可能相差数十倍。
沃特世的色谱数据软件Empower®网络版具有强大的功能,能够有效提高实验检测效率,并允许用户通过移动设备随时随地监控色谱系统。而针对非色谱类仪器,沃特世则提供另一种数据管理解决方案NuGenesis®SDMS科学数据管理系统,它可以自动采集、编目原始数据和报告数据,将仪器的原始数据归档至安全、可靠的Oracle数据库中,符合电子记录和电子签名的规定等,最终帮助企业满足法规要求。
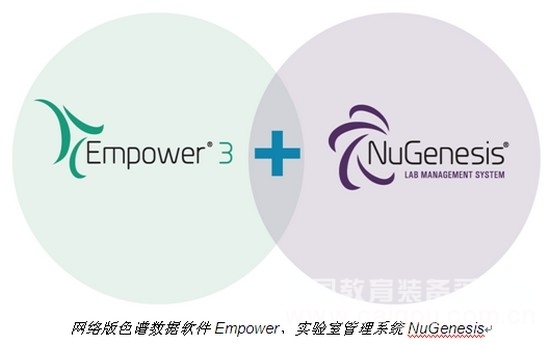
计算机化系统验证比较耗时且操作复杂,需要多领域的专家花费大量时间去完成。沃特世从欧洲ISPE制药工程协会聘请了资深的验证咨询顾问Charlie Wakeham女士(GAMP5指南的编辑之一),为国内制药企业提供全套专业的合规性和验证服务,并协助广大用户顺利完成验证工作,使系统尽快投入运行,并满足法规要求。

Charlie Wakeham女士进行现场培训
在沃特世近期举办的北京及成都培训会上,Charlie Wakeham女士与沃特世公司的法规及产品专家介绍了大家特别关注的美国21 CFR Part 11法案、欧盟的Annex 11法案以及ISO 17025标准的共同点和不同点。同时,CharlieWakeham女士还就计算机系统验证的准备工作及如何获取所需的信息作讲解。此外,沃特世中国信息学产品市场经理金勇先生为与会者全面解读了《计算机化系统》的重要内容,并介绍了沃特世公司的相关解决方案,包括网络版色谱数据软件Empower®、实验室管理系统NuGenesis®以及专业验证CSV(Computerized System Validation, CSV)服务。近两百位来自跨国公司、研究院所和国内知名企业的质量主管、研发负责人和合规主管参加了北京及成都举办的培训。

沃特世培训会现场
沃特世中国信息学产品市场经理金勇表示:“沃特世公司此次为广大中国制药企业全面解读全新法规附录,正是希望能够利用沃特世业界领先的实验室信息学解决方案,帮助中国制药企业有效降低成本,满足更严格的数据合规性与安全性要求。”













![聚酰胺粉 [柱层析用,高分离性能] 60-100目/80-120目/100-200目](https://p-06.caigou.com.cn/135x120/2024/7/2024071513085253637.jpg)